EXPAND
研究设计
EXPAND III 期研究设计:事件驱动的设计允许设置充分观察期,以评估疗效和安全性,同时减少安慰剂暴露1
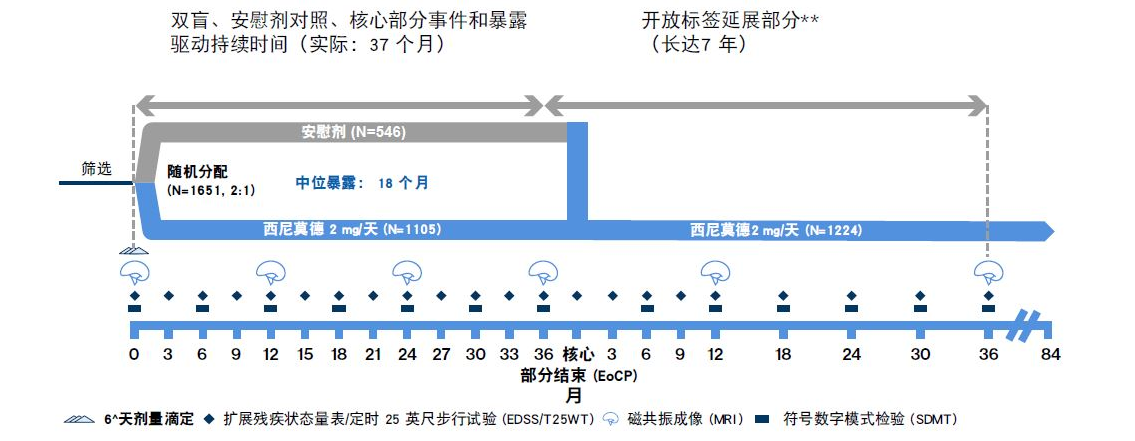
**开放标签部分在患者出现确认的残疾进展“事件”时开始。^开始治疗时,滴定期为 6 天 (0.25 mg-2 mg),第 6 天达到首次维持剂量 2 mg。
这项 III 期 EXPAND 研究是一项随机、平行组、双盲、安慰剂对照、事件驱动和暴露驱动的核心部分(长达 3 年),随后是开放标签展部分(长达 7 年),收集长期数据长达 10 年,以评估西尼莫德的疗效和安全性。将继发进展型多发性硬化 (SPMS) 患者(18-60岁)和扩展残疾状态量表 (EDSS) 评分为 3.0 - 6.5 的患者随机分配 (2:1) 接受每日一次口服西尼莫德2 mg或 安慰剂,最长持续 3 年,或直到发生预先指定数量的 CDP 事件。主要终点为至 3 个月 CDP 的时间。如果基线评分为 3.0 - 5.0,CDP 定义为 EDSS 增加 1 分;如果基线评分为 5.5 - 6.5,则 CDP 定义为 EDSS 增加 0.5 分,且在至少 3 个月后的计划访视中确认。两个关键次要临床终点是 25 英尺步行 (T25FW) 试验中相对于基线至少变化 20% 的 3 个月 CDP 时间和 T2 病灶体积相对于基线的变化1这项 III 期 EXPAND 研究是一项随机、平行组、双盲、安慰剂对照、事件驱动和暴露驱动的核心部分(长达 3 年),随后是开放标签展部分(长达 7 年),收集长期数据长达 10 年,以评估西尼莫德的疗效和安全性。将继发进展型多发性硬化 (SPMS) 患者(18-60岁)和扩展残疾状态量表 (EDSS) 评分为 3.0 - 6.5 的患者随机分配 (2:1) 接受每日一次口服西尼莫德2 mg或 安慰剂,最长持续 3 年,或直到发生预先指定数量的 CDP 事件。主要终点为至 3 个月 CDP 的时间。如果基线评分为 3.0 - 5.0,CDP 定义为 EDSS 增加 1 分;如果基线评分为 5.5 - 6.5,则 CDP 定义为 EDSS 增加 0.5 分,且在至少 3 个月后的计划访视中确认。两个关键次要临床终点是 25 英尺步行 (T25FW) 试验中相对于基线至少变化 20% 的 3 个月 CDP 时间和 T2 病灶体积相对于基线的变化1
- 需要 374 例 3mCDP 事件,且 >95% 随机化患者需要暴露于药物 ≥ 1 年
- 出现 6mCDP 的患者可以选择转用开放标签西尼莫德或其他疾病修饰药物 (DMT),同时留在本研究的核心部分内
- 在核心部分结束 (EoCP) 时,患者可以选择进入仍在持续进行的标签延展部分,并接受西尼莫德治疗长达额外 7 年

EXPAND 人群:患者人口统计学和基线疾病特征1
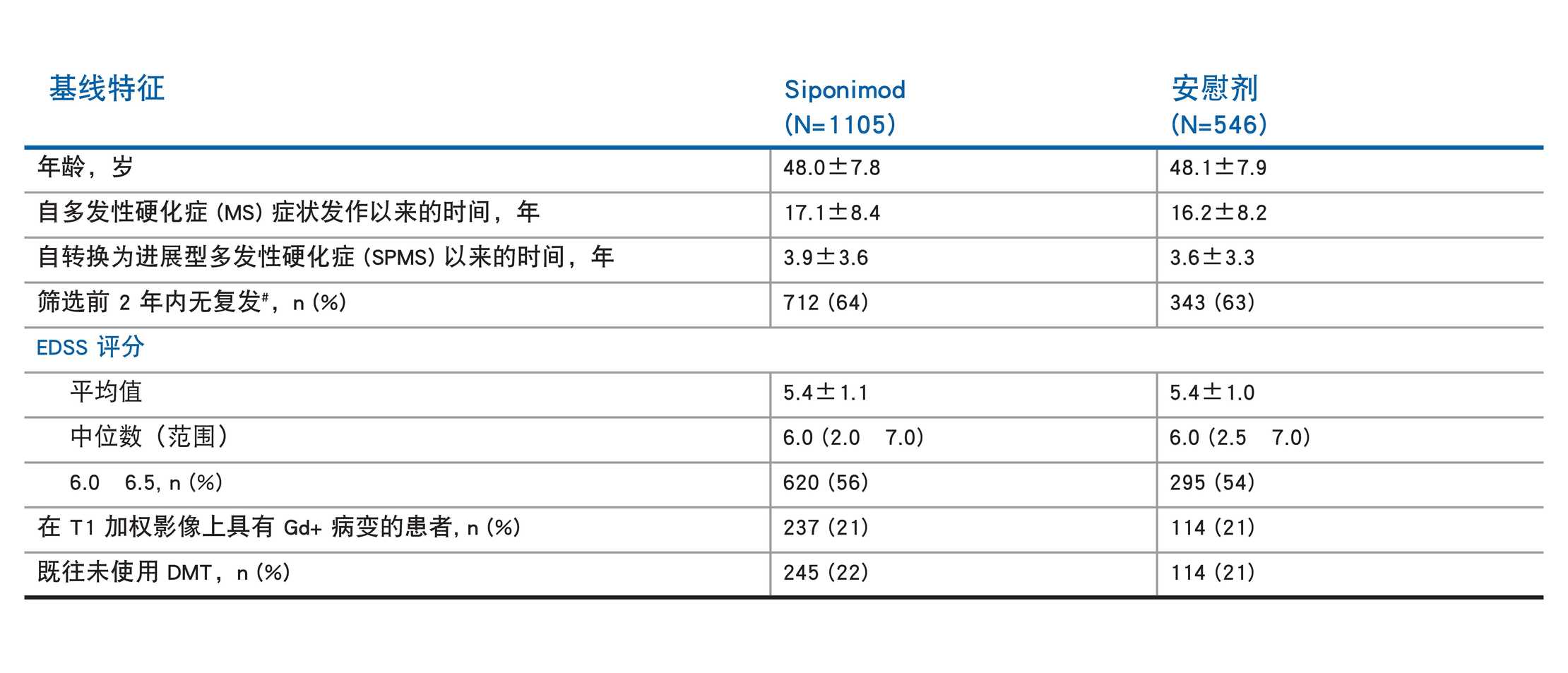
#数据表示为平均值 ± 标准差 (SD),除非另有说明
^西尼莫德组的 3 例患者和安慰剂组 1 例患者未提供过去 2 年的复发次数信息

EXPAND SPMS 人群和 III 期复发型多发性硬化 (RMS) 试验:患者人口统计资料和基线
疾病特征 1‒7
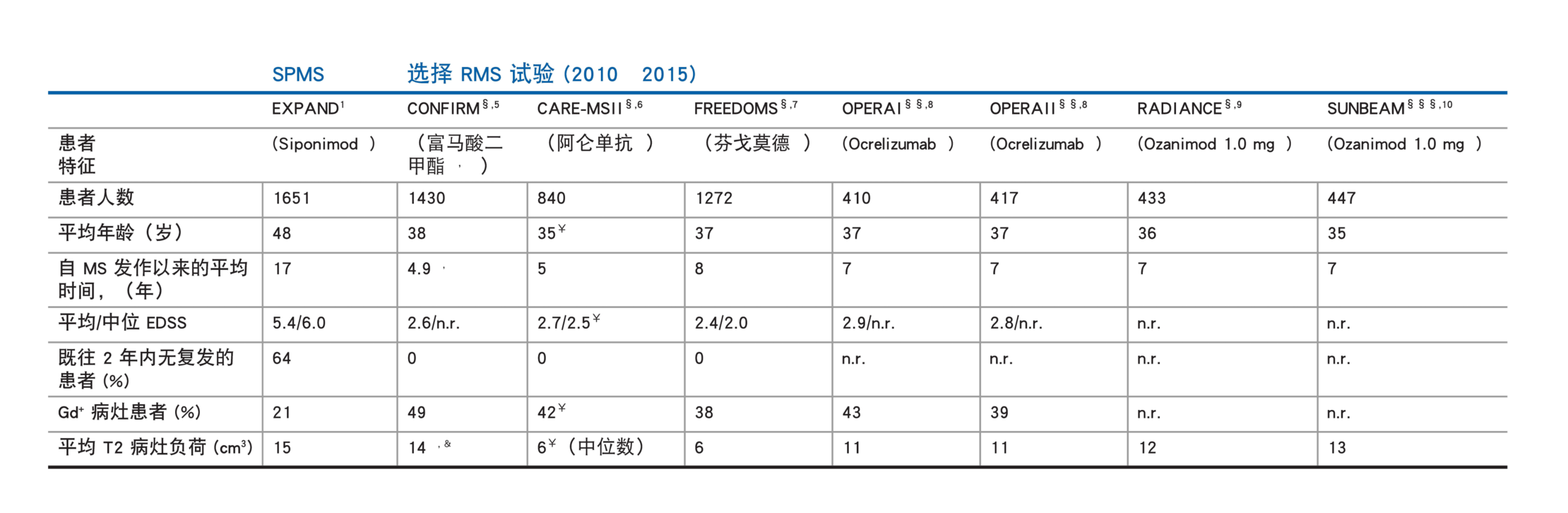
由于没有开展西尼莫德与这些药物的对照试验,且研究设计存在差异,因此无法进行比较
#第 2 年;##第 96 周;###第 12 个月;§安慰剂对照;¶醋酸格拉替雷对照药;ǁIFN β-1a 对照药;ɭ包括接受奥瑞珠单抗或 ozanimod 的患者的数据;ʄ仅富马酸二甲酯每日两次组;‡仅阿仑单抗 12 mg 组;ʆ自诊断起的时间;¥基于入选标准;ƔEDSS 评分高于 5.0;Ĭ磁共振成像 (MRI) 队列
