It looks like you are using an older version of Internet Explorer which is not supported. We advise that you update your browser to the latest version of Microsoft Edge, or consider using other browsers such as Chrome, Firefox or Safari.




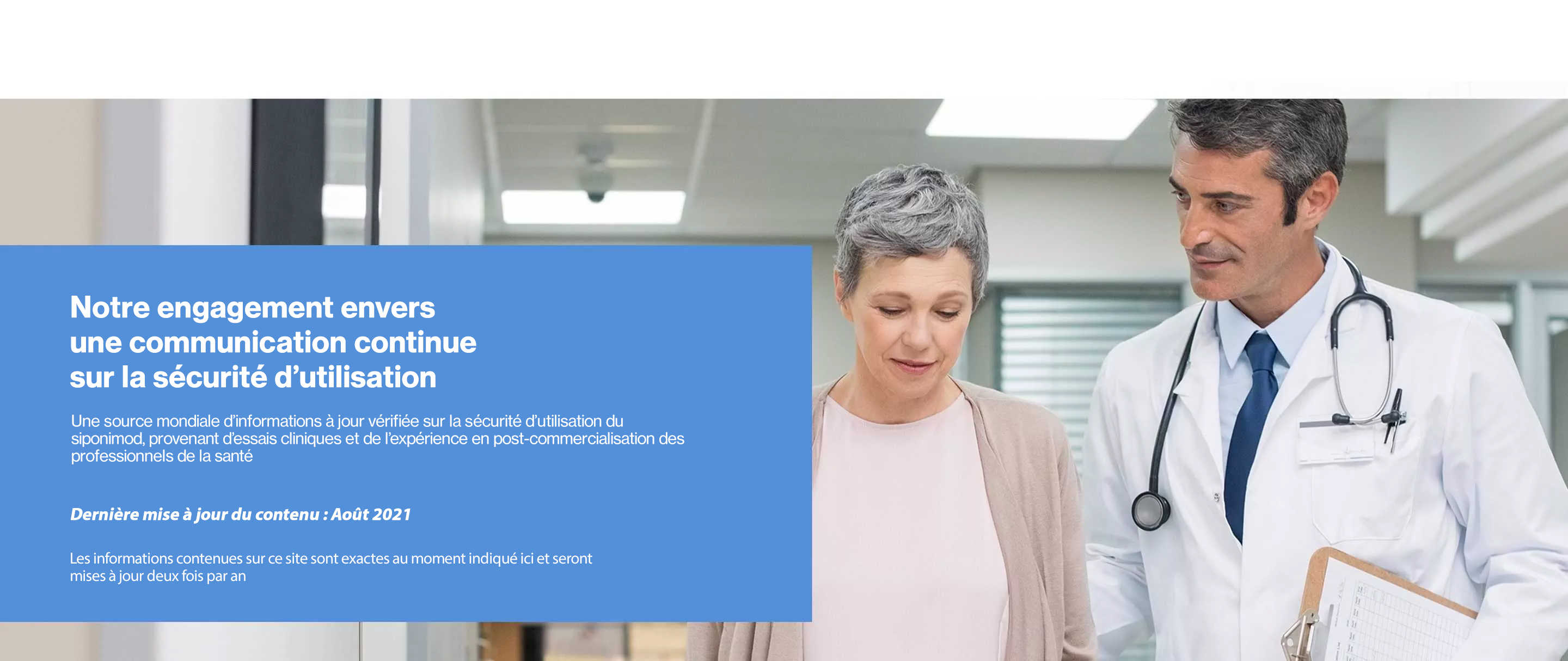
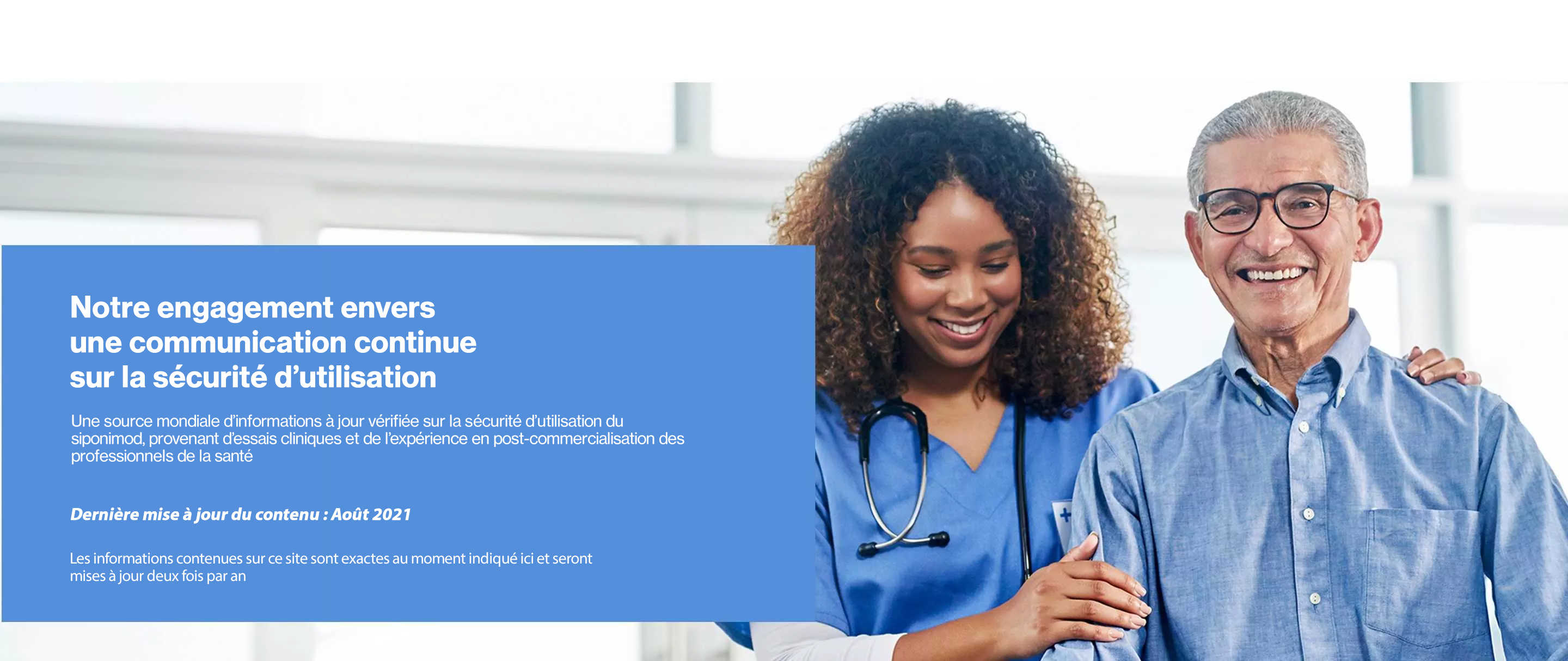
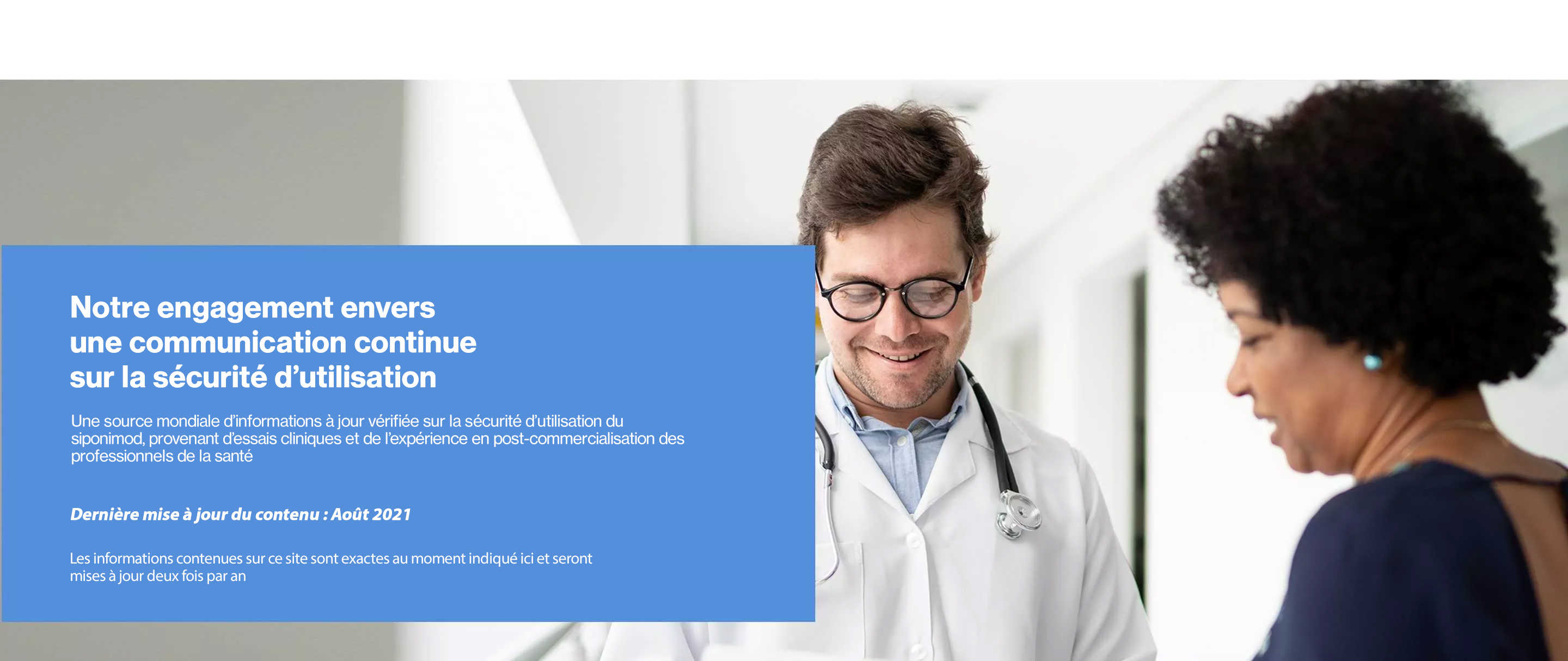
This website is for non-promotional purposes and is intended for providing
safety information for healthcare professionals (HCPs) Only
Please confirm that you are an HCP
For HCPs: Information on this website is not country specific, and may contain information that is outside the approved indications in the country in which you are located. Please contact your local Novartis representative for the latest information specific to your country.
For non-HCPs / patients: This safety website is available for HCPs only
Le programme de suivi intensif de l’issue de la grossesse (Pregnancy outcome Intensive Monitoring, PRIM) est basé sur une pharmacovigilance améliorée du système de déclaration spontanée de Novartis. Le PRIM est un programme de suivi intensif des issues des événements indésirables visant à recueillir des informations (listes de contrôle de suivi ciblées) sur la grossesse chez les patientes exposées au siponimod immédiatement avant ou pendant la grossesse et l’issue relative au nourrisson 12 mois après l’accouchement.