COVID-19
Dernière mise à jour : juin 2022. La page sera mise à jour deux fois par an
It looks like you are using an older version of Internet Explorer which is not supported. We advise that you update your browser to the latest version of Microsoft Edge, or consider using other browsers such as Chrome, Firefox or Safari.
Dernière mise à jour : juin 2022. La page sera mise à jour deux fois par an
Novartis surveille régulièrement les cas de COVID-19 chez les patients sous traitement par siponimod. Sur la base de l’ensemble des données disponibles issues des rapports de cas de COVID-19 dans le cadre des essais cliniques et de la pharmacovigilance, ainsi que sur l’analyse complète des données par le GDSI de la MS Data Alliance.1
|
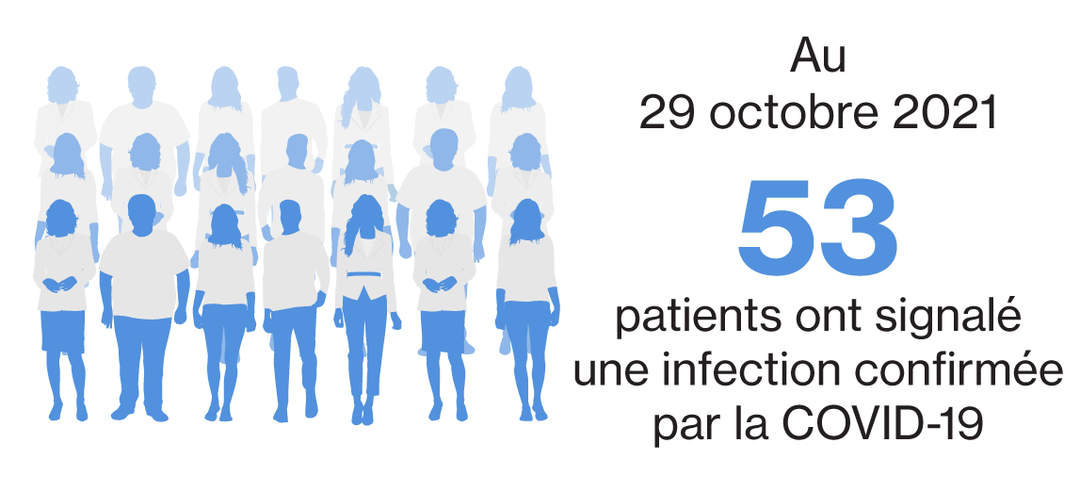
Au 25 mars 2022, avec une exposition cumulée de plus de 15 163 patients-années, un total de 267 cas, soit COVID-19 confirmée ** (n=262) ou COVID-19 suspectée ^ (n=5), ont été identifiés avec un traitement par siponimod après sa commercialisation.2 Il y avait 54 cas provenant d'essais cliniques en cours, avec 53 cas confirmés** et un cas suspect au 29 octobre 2021.3 |

Expérience post-AMM
Sur les 262 cas confirmés de COVID-19, 75 étaient graves
Sur les 53 cas confirmés de COVID-19, 17 étaient graves

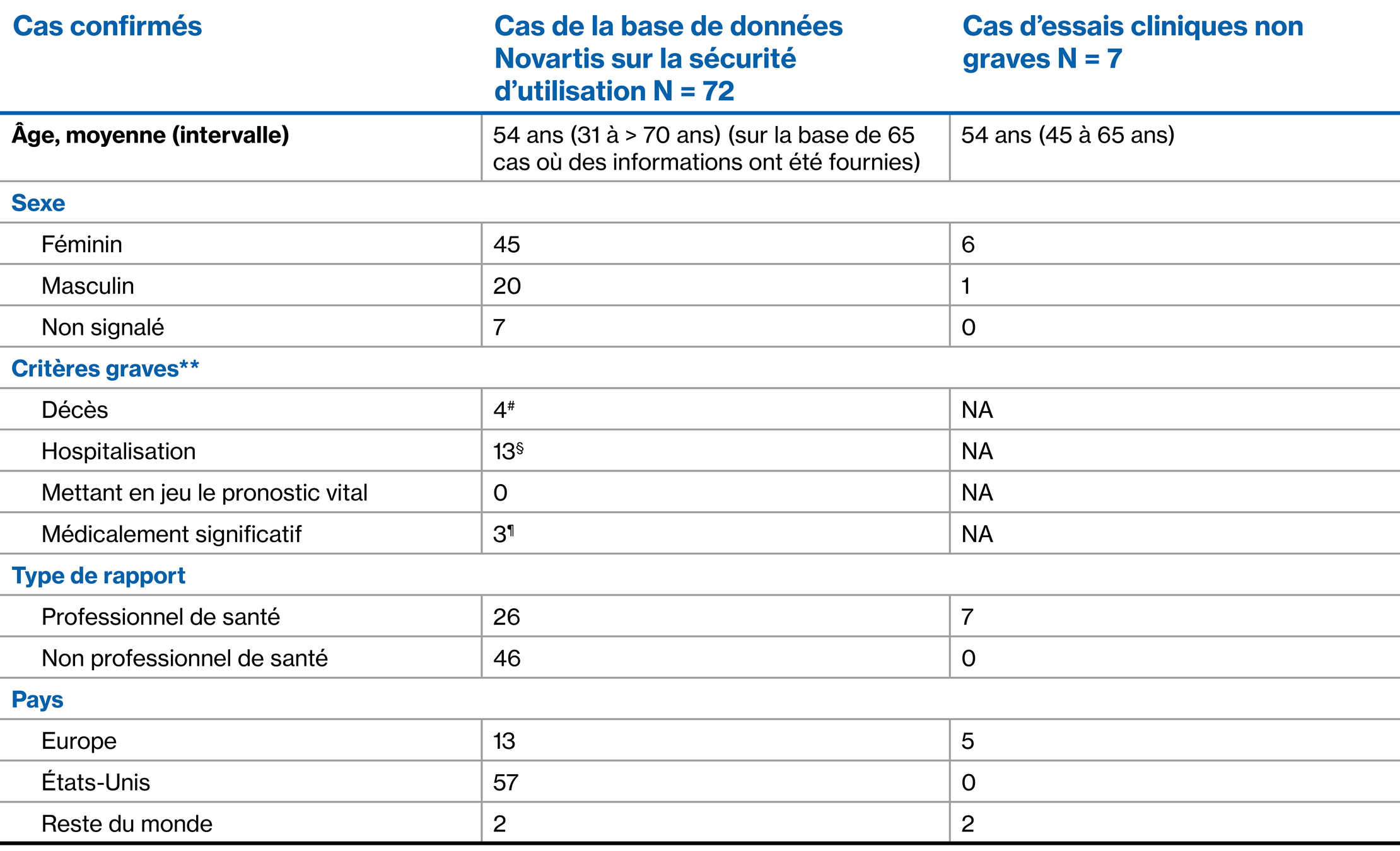
Infection COVID-19 : Cas confirmés2,3
Novartis surveille régulièrement la réponse clinique au vaccin contre la COVID-19 chez les patients sous traitement par siponimod, reçue des essais cliniques ou de la post-commercialisation.
Dans les CT, sur les 320 patients entièrement vaccinés (45 patients supplémentaires ont reçu une dose partielle, 7 patients ont présenté une percée de l'infection par la COVID-19 (c'est-à-dire ≥2 semaines après 2 doses de vaccin, ou ≥2 semaines après une dose d'un schéma à dose unique). Cela inclut un patient avec des comorbidités qui a eu une issue fatale et 6 patients qui ont récupéré.

ꞁToute prophylaxie pré et post-exposition doit être administrée conformément aux directives locales et aux informations sur le produit correspondant.

This website is for non-promotional purposes and is intended for providing
safety information for healthcare professionals (HCPs) Only
Please confirm that you are an HCP
For HCPs: Information on this website is not country specific, and may contain information that is outside the approved indications in the country in which you are located. Please contact your local Novartis representative for the latest information specific to your country.
For non-HCPs / patients: This safety website is available for HCPs only
Le programme de suivi intensif de l’issue de la grossesse (Pregnancy outcome Intensive Monitoring, PRIM) est basé sur une pharmacovigilance améliorée du système de déclaration spontanée de Novartis. Le PRIM est un programme de suivi intensif des issues des événements indésirables visant à recueillir des informations (listes de contrôle de suivi ciblées) sur la grossesse chez les patientes exposées au siponimod immédiatement avant ou pendant la grossesse et l’issue relative au nourrisson 12 mois après l’accouchement.