EXPAND
Devis de l’étude
Devis de l’étude de phase 3 EXPAND : La conception axée sur les événements a permis une période d’observation adéquate afin d’évaluer l’efficacité et la sécurité d’utilisation tout en réduisant l’exposition au placebo1
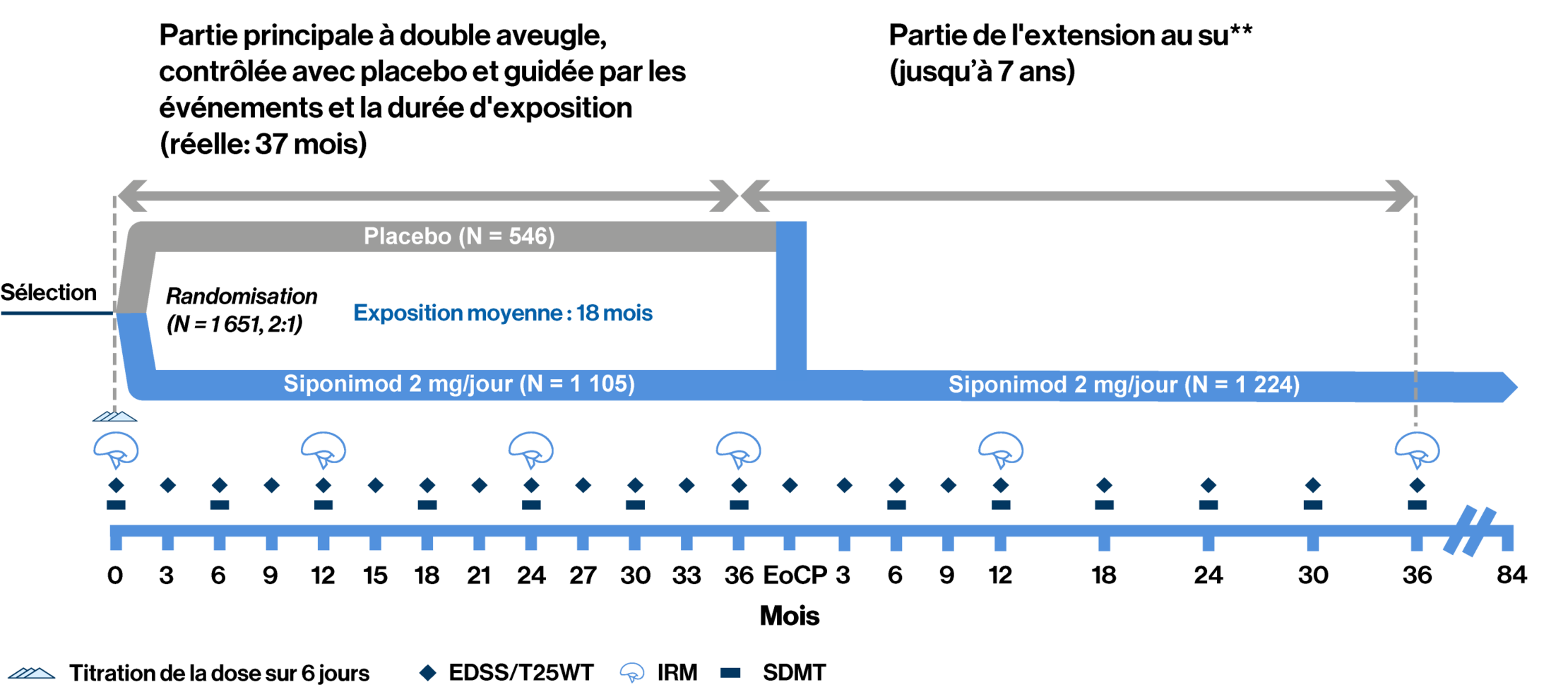
* La partie au su commence lorsqu’un patient présente un « événement ». ** Le traitement a été instauré avec une période d’ajustement posologique de 6 jours (0,25 mg-2 mg) avec la première dose de maintien de 2 mg atteinte au Jour 6.
L’étude EXPAND de phase 3 comprenait une partie principale, randomisée, contrôlée contre placebo, en groupes parallèles, double aveugle, axée sur les événements et sur l’exposition (jusqu’à 3 ans), suivie d’une extension au su (jusqu’à 7 ans) qui a recueilli des données à long terme afin d’évaluer l’efficacité et la sécurité d’utilisation du siponimod pendant 10 ans au maximum. Des patients (âgés de 18 à 60 ans) atteints d’une SEP-SP et présentant un score EDSS de 3,0 à 6,5 ont été randomisés de manière aléatoire (2:1) pour recevoir une dose orale de 2 mg de siponimod une fois par jour ou un placebo pendant 3 ans au maximum ou jusqu’à la survenue d’un nombre prédéfini d’événements de PIC. Le critère d’évaluation principal était le délai jusqu’à la PIC à 3 mois. La PIC était définie comme une augmentation de 1 point du score EDSS si le score à l’inclusion était compris entre 3,0 et 5,0, ou une augmentation de 0,5 point si le score à l’inclusion était compris entre 5,5 et 6,5, ceci confirmée lors d’une visite prévue au moins 3 mois plus tard. Les deux principaux critères d’évaluation secondaires étaient le délai jusqu’à une PIC à 3 mois d’au moins 20 % par rapport à l’inclusion dans le test T25FW et la variation du volume des lésions en T2 par rapport à l’inclusion
- 374 événements de 3mPIC et ≥ 1 an d’exposition pour > 95 % des patients randomisés étaient nécessaires
- Les patients atteignant une 6mPIC avaient la possibilité de passer au siponimod au su ou à d’autres TMM tout en restant dans la partie principale de l’étude
- À la fin de la partie principale (FdPP), les patients avaient la possibilité d’intégrer l’extension de l’essai toujours en cours, au su et de recevoir le siponimod pendant 7 années additionnelles au maximum
Population de l’étude EXPAND : Données démographiques des patients et caractéristiques de la maladie à l’inclusion 1
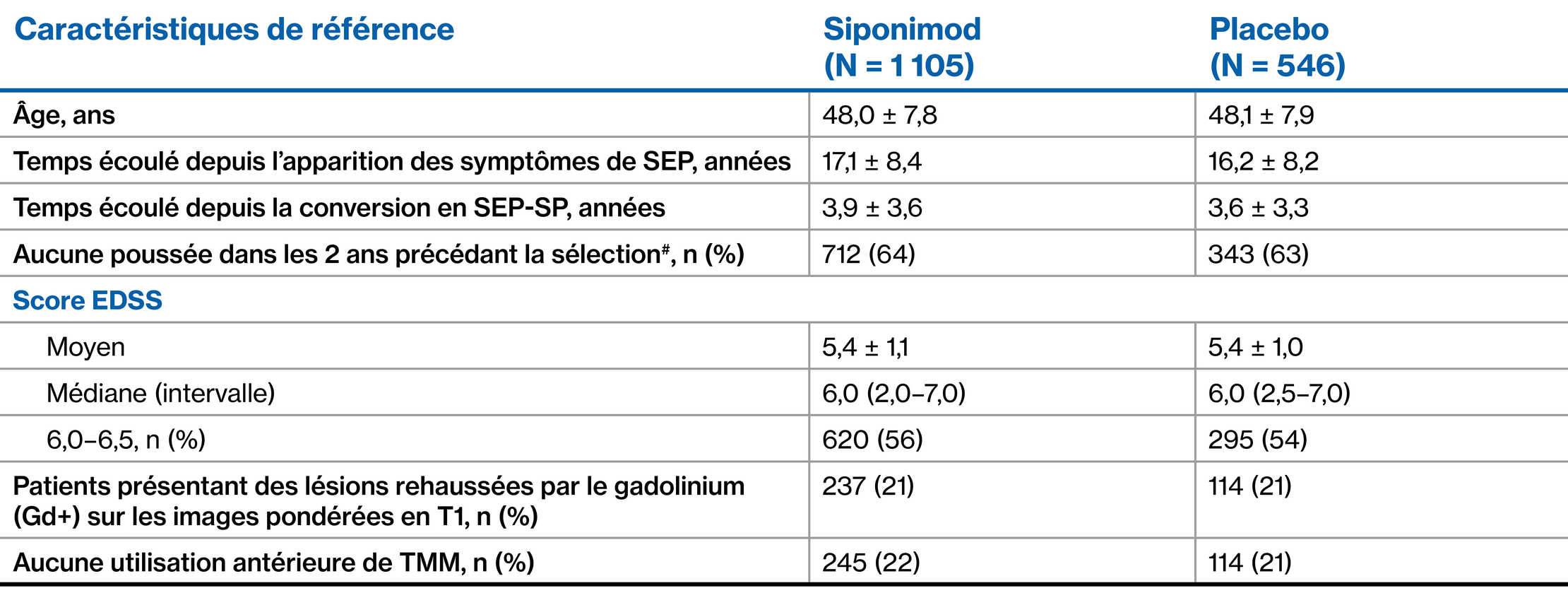
Les données sont présentées sous forme de moyenne ± ET, sauf indication contraire
^ Les informations sur le nombre de poussées survenues au cours des 2 dernières années n’étaient pas disponibles pour trois patients du groupe siponimod et un patient du groupe placebo

Population SEP-SP de l’étude EXPAND et des essais de phase 3 sur la SEP-RR : Données démographiques des patients et caractéristiques de la maladie à l’inclusion 1‒7
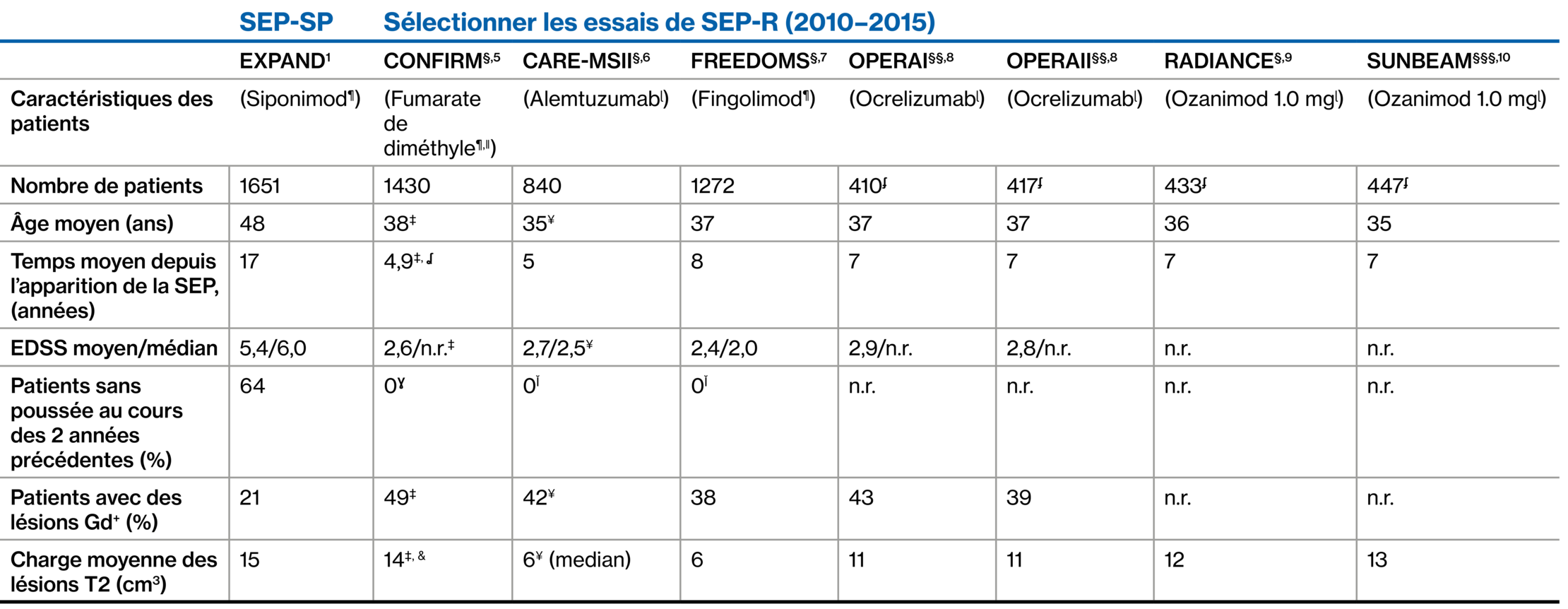
Étant donné qu’il n’existe pas d’essais comparatifs du siponimod par rapport à ces agents, aucune comparaison n’a pu être effectuée en raison de différences dans la conception de l’étude