AMA-VACC
Résultats de l’analyse intermédiaire1
Tjalf Ziemssen, et al. Assessing the immune response to SARSCoV-2 mRNA vaccines in patients with secondary progressive multiple sclerosis treated with siponimod (AMAVACC clinical trial). Présentation par affiche à l’AAN 2022
Réponse immunitaire combinée aux vaccins à ARNm contre le SARS-COV-2
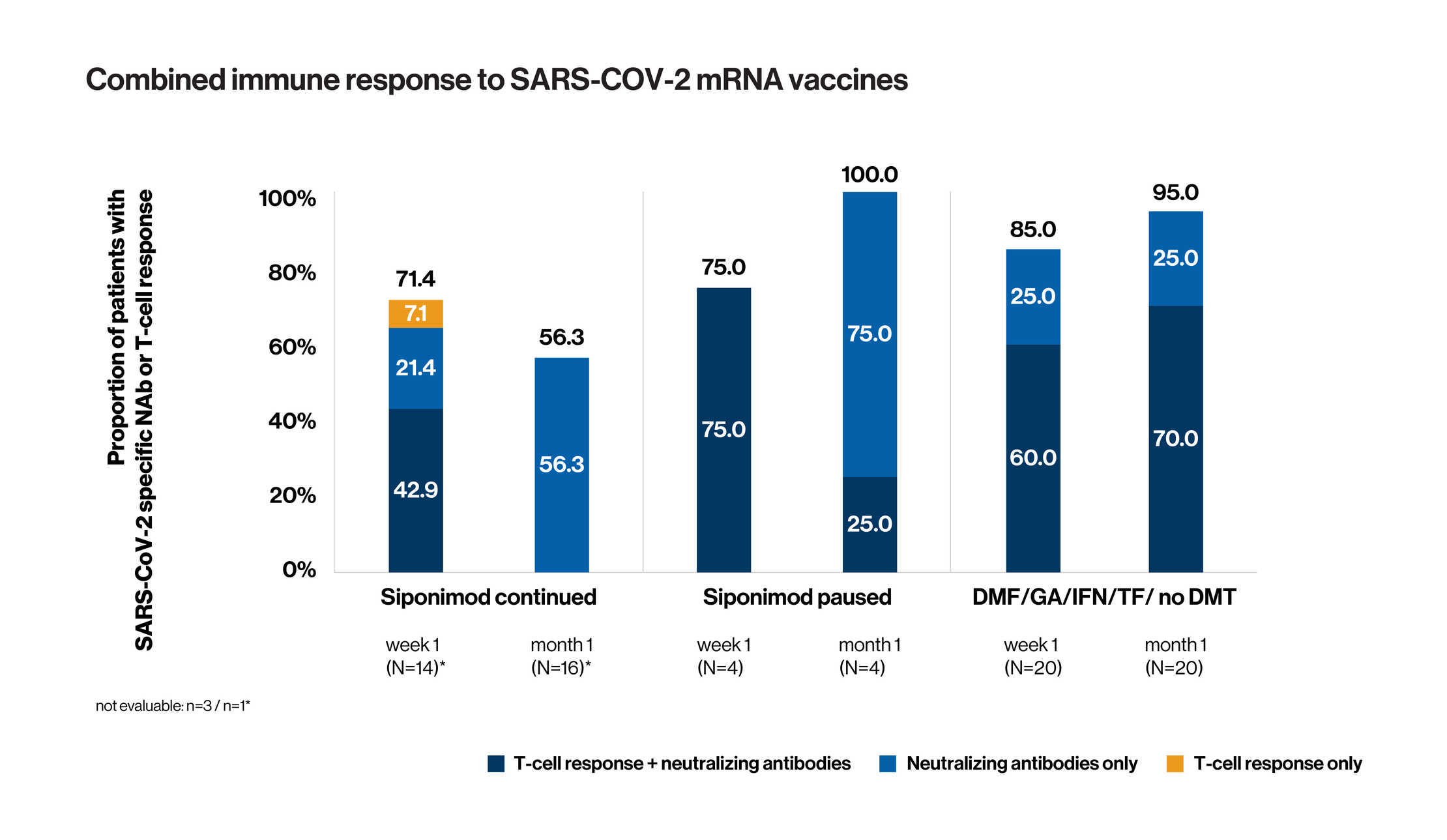
Les données présentées concernent les patients dont les anticorps et les cellules T ont été évalués.
- L'essai clinique AMA-VACC a évalué les données sur les vaccinations contre le SARS-CoV-2 chez les patients atteints de SPPS traités par siponimod dans le but d'offrir une orientation aux médecins traitants et aux patients pour la coordination du traitement de la SEP et de la vaccination.
- L'étude a évalué la réponse immunitaire chez les patients atteints de SPPS traités par le siponimod après une vaccination initiale et une vaccination de rappel avec le vaccin ARN messager contre le SARS-CoV-2.
- Essai prospectif, ouvert, à trois cohortes
- 41 patients inclus dans l'analyse intermédiaire (17 dans la cohorte 1 : traitement continu par siponimod pendant la vaccination ; 4 dans la cohorte 2 : siponimod interrompu pour la vaccination ; et 20 patients dans la cohorte 3 : TMM de première ligne/aucun traitement actuel).
- Un anticorps neutralisant a pu être détecté à un moment donné, soit à une semaine, soit à un mois, soit aux deux moments) chez 65 % des patients traités en continu par le siponimod et 95 % des patients sous TMM de première ligne.
- Une réponse lymphocytaire T spécifique anti-SARS-CoV-2 a été observée dans 50 %, 75 % et 60 % des cohortes 1, 2 et 3, respectivement (données non présentées).
- Au total, plus de 70 % des patients sous traitement continu par le siponimod ont développé une réponse immunitaire (c'est-à-dire une réponse humorale ou cellulaire, ou les deux) contre les vaccins à ARN messager contre le SARS-CoV-2 dès la première semaine suivant la vaccination complète.
- Jusqu'à la date butoir de cette analyse intermédiaire, une rechute est survenue pendant l'étude (cohorte 1, >5 mois après la dernière vaccination).
- Aucune infection par COVID-19 n'a été signalée, et aucun événement indésirable n'a conduit à l'arrêt définitif du médicament de l'étude jusqu'à la date butoir.
L'analyse intermédiaire montre que plus de 2 patients sur 3 atteints de SPPS sous siponimod développent une réponse immunitaire aux vaccins à ARN messager contre le SARS-CoV-2 et que les patients traités par siponimod peuvent présenter des réponses immunitaires humorales et cellulaires, deux éléments qui doivent être pris en compte pour évaluer l'efficacité de la vaccination.
(Nouvelle) Analyse intermédiaire de l’étude AMA-VACC