Extension BOLD
Effet du siponimod sur la titration de la dose
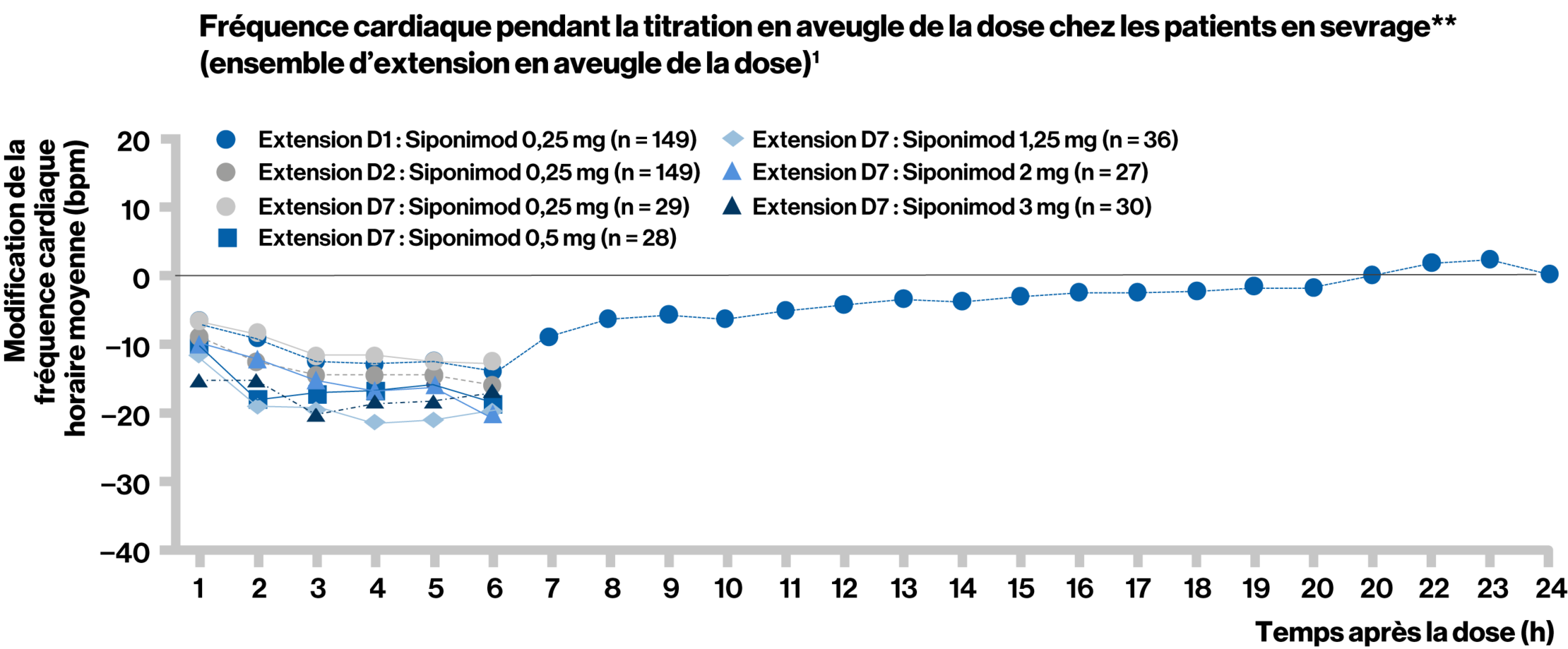
La titration de la dose a efficacement réduit l’effet chronotrope négatif du siponimod observé à des doses plus élevées dans l’étude BOLD.
* Les patients présentant un sevrage thérapeutique sont ceux qui ont plus de 7 jours d’interruption du médicament à l’étude entre la date de la dernière prise du médicament à l’étude dans l’étude BOLD et la date de la première dose du médicament à l’étude d’extension, et tous les patients randomisés pour recevoir le placebo dans l’étude BOLD.
L’extension BOLD était une phase d’extension en aveugle vis-à-vis de la dose de l’étude BOLD de phase 2 qui a duré jusqu’à 24 mois, suivie d’un traitement par siponimod au su ouvert qui a déterminé la sécurité d’utilisation et l’efficacité et évalué l’effet d’atténuation de la titration de la dose du siponimod sur les variations de la fréquence cardiaque pendant l’instauration du traitement.
