EXPAND
Sécurité
Population de l’étude EXPAND : Profil de sécurité d’utilisation global1-3
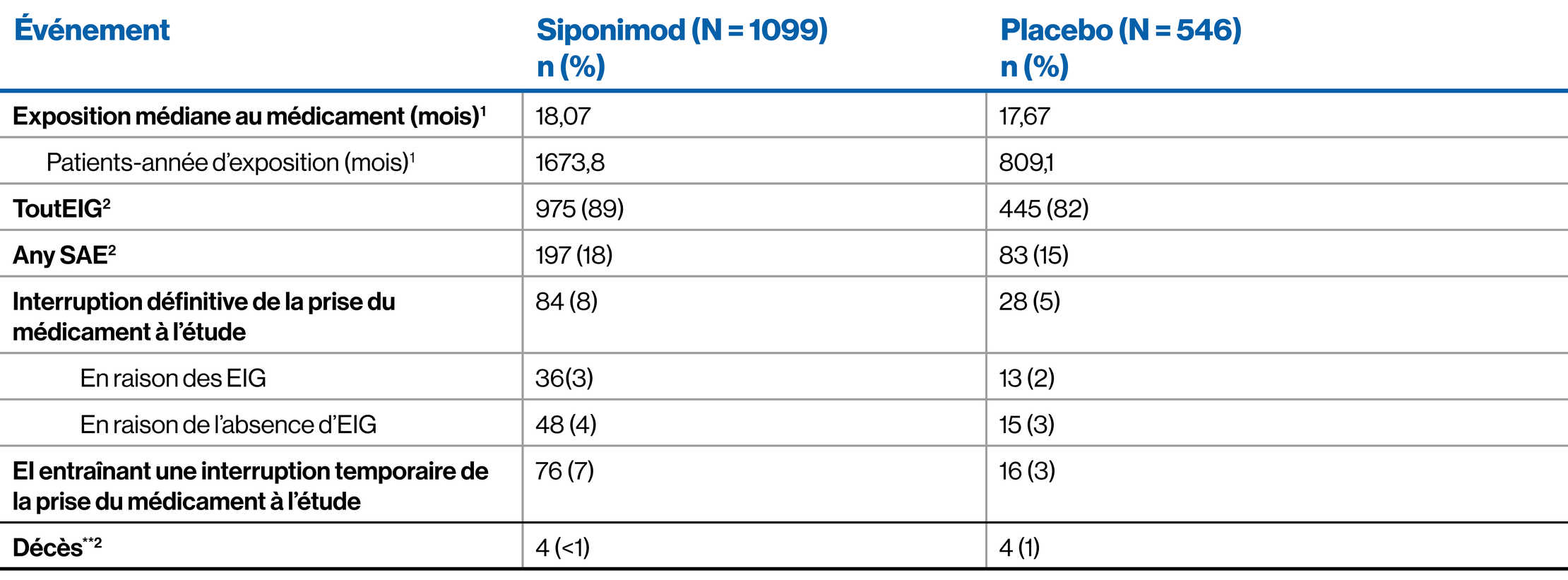
** Les décès dans le groupe siponimod étaient dus à un mélanome gastro-intestinal métastatique dans les 4 mois suivant le début du traitement par siponimod ; un choc septique chez un patient atteint d’un cancer du côlon terminal ; un urosepsis plus de 10 semaines après l’arrêt du siponimod et après deux doses de rituximab ; et un suicide. Un autre patient atteint d’un carcinome pulmonaire métastatique a retiré son consentement à l’étude après avoir pris du siponimod pendant 11 mois ; ce patient est décédé (raison non spécifiée) environ 5 mois après l’arrêt du médicament à l’étude. Les décès dans le groupe placebo étaient dus à un AVC hémorragique, un cancer du poumon, un cancer gastrique et pour une raison inconnue.
Population de l’étude EXPAND : EI les plus fréquents (≥ 5 % des patients dans l’un ou l’autre groupe)2
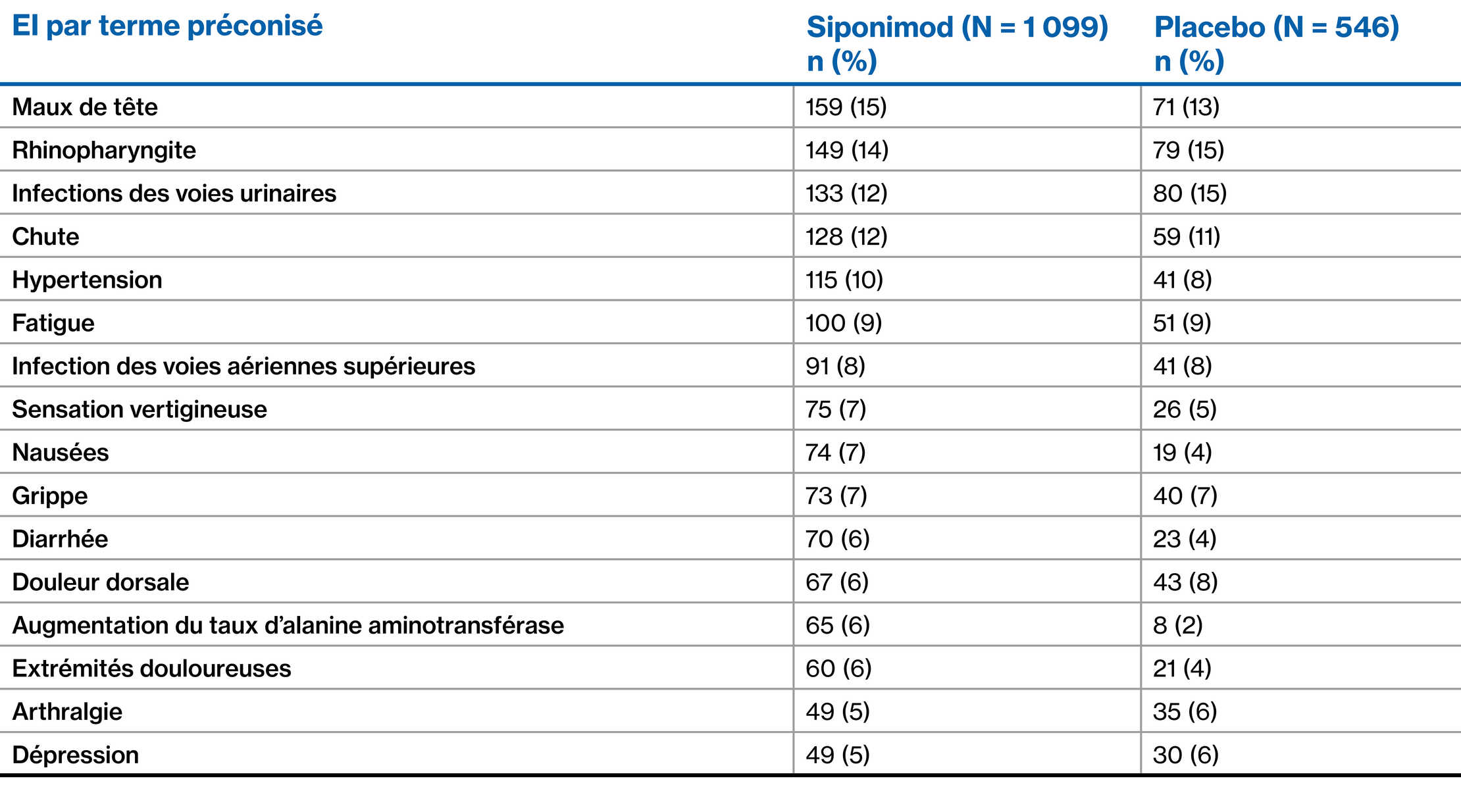
** Les EI ont été codés conformément au MedDRA, version 19·0.
Données présentées à partir de l’étude de phase 3 contrôlée par placebo EXPAND

Population de l’étude EXPAND : EIG (≥ 0,5 % des patients dans l’un ou l’autre groupe)2
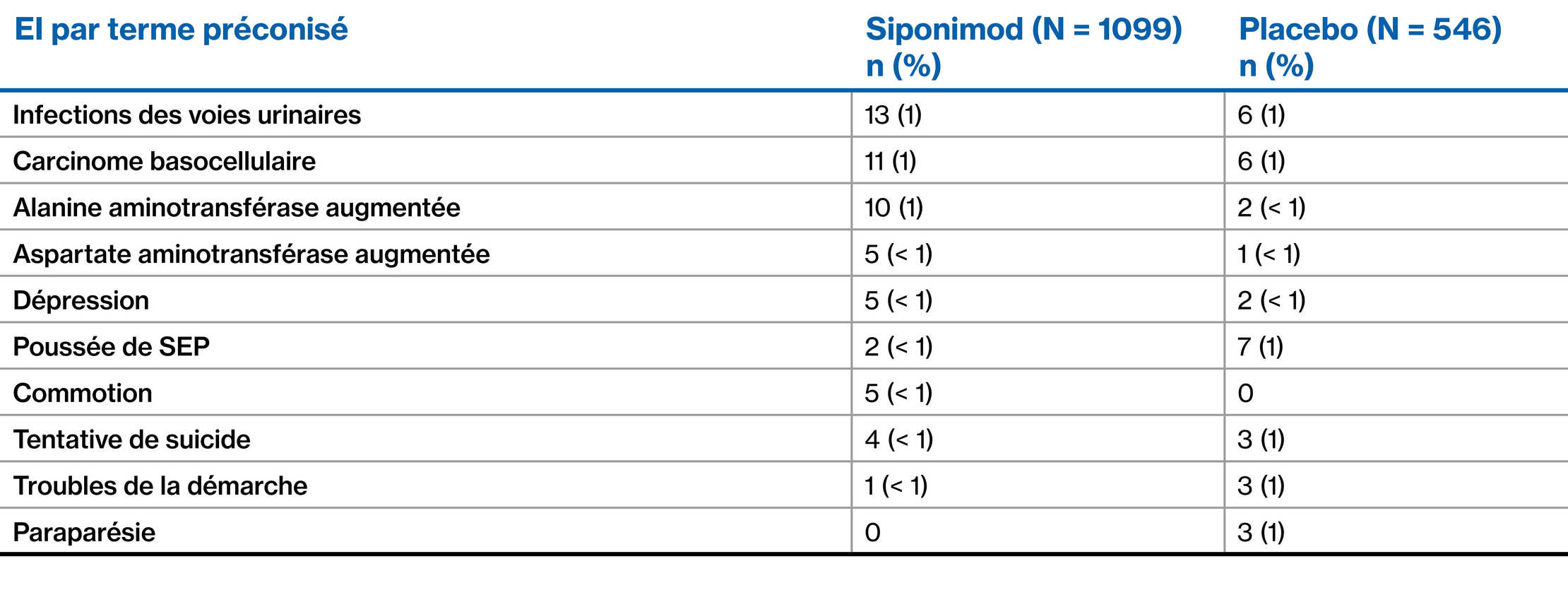
Les données sont présentées à partir de l’étude de phase 3 contrôlée par placebo EXPAND

EI d’intérêt particulier
- Les EI d’intérêt particulier comprennent les effets pharmacodynamiques bien connus des modulateurs de la S1P, les risques associés à l’immunosuppression et certains événements survenant avec les S1P, mais pour lesquels le mécanisme reste non défini.
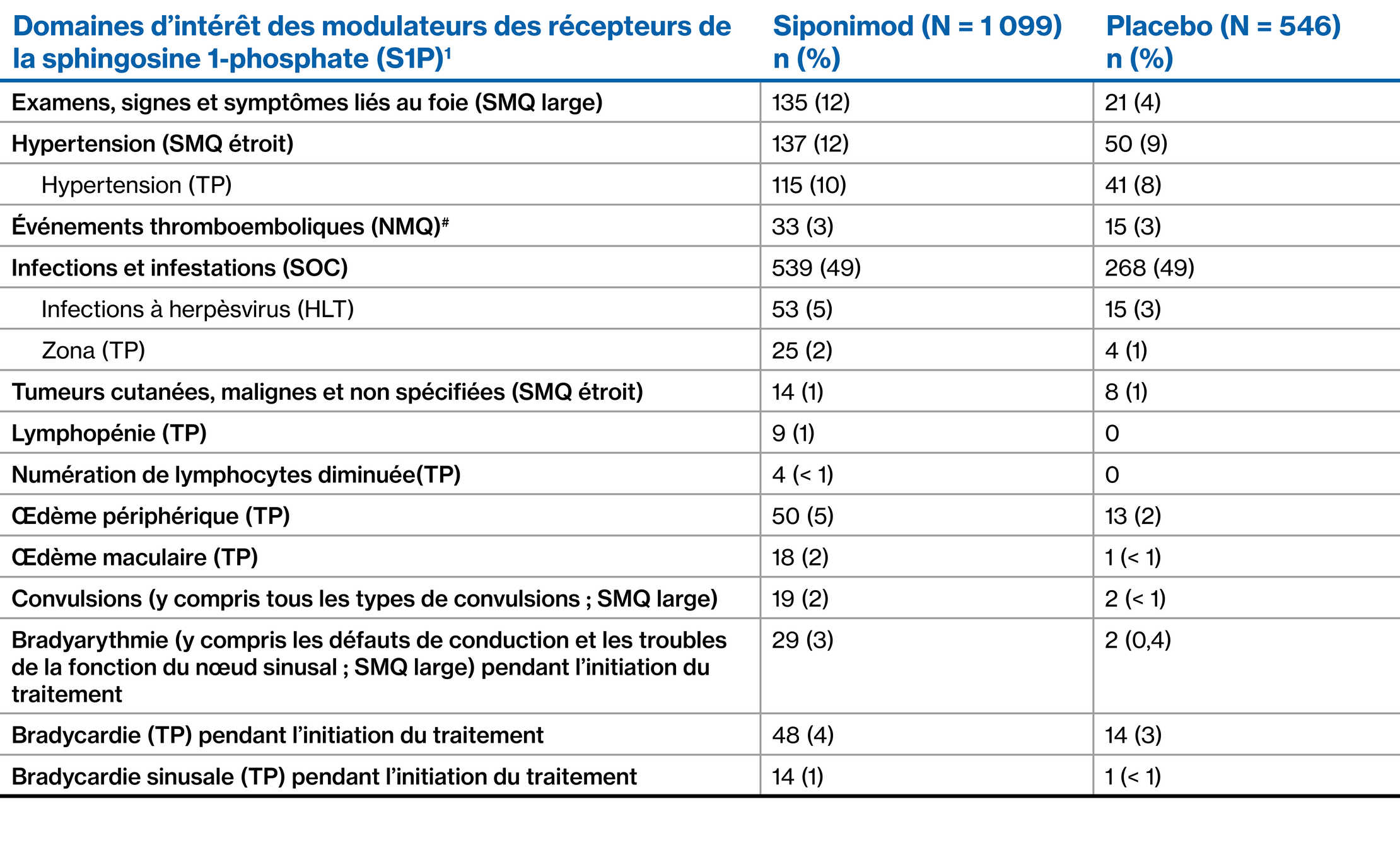
^ Inclure les « hémorragies du système nerveux central et les affections vasculaires cérébrales (SMQ large) », « événements emboliques et thrombotiques, artériels (SMQ) » et « cardiopathie ischémique (SMQ large) ».
