Toxicité pour la reproduction
D’après des études menées chez les animaux, le siponimod peut nuire au fœtus. Les femmes en âge de procréer doivent utiliser une contraception efficace pour éviter une grossesse pendant le traitement par siponimod et pendant 10 jours après l’arrêt de celui-ci.1,2.
PRIM non américain
| Si le test de grossesse s’avère positif, veuillez contacter le registre. |
Pour le registre américain


Au 30 octobre 2020, 27 grossesses ont été rapportées à partir d’essais cliniques et aucune dans le contexte post-AMM au 25 mars 2021 avec le siponimod.
- Une exposition maternelle au siponimod a été rapportée chez 15 femmes pendant la grossesse ; 5 femmes avaient été exposées avant la grossesse ; le délai d’exposition n’était pas spécifié chez une femme.
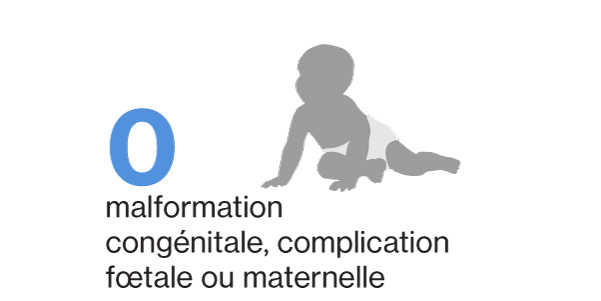
Aucun événement de malformation congénitale (y compris majeure et mineure) et de complication fœtale ou maternelle liée à la grossesse et à l’accouchement n’a été rapporté chez les femmes enceintes exposées au siponimod 4.
