Évidences de données réelles
Étude longitudinale UCSF : analyse intermédiaire
Sabatino J et al. Analyse longitudinale de l'immunité adaptative après une vaccination supplémentaire par le vaccin contre le SARS-CoV-2 chez des patients atteints de SEP sous traitement anti-CD20 et modulateurs du récepteur de la sphingosine-1-phosphate.
Figure : Réponses des anticorps à la vaccination par le vaccin contre le SARS-CoV-2 pour les différents groupes à chaque point temporel.
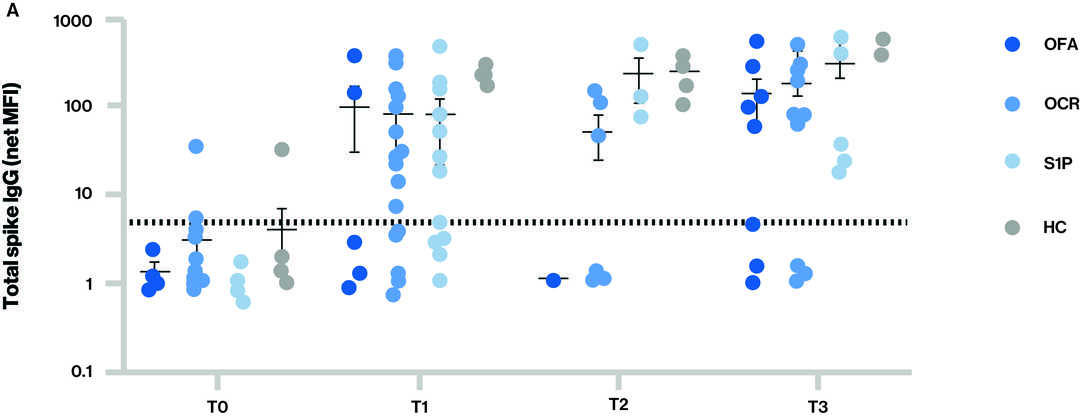
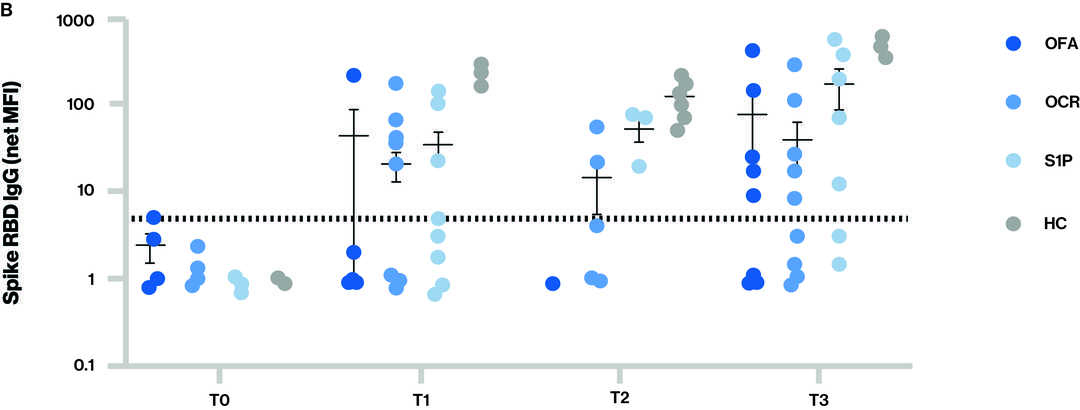
La ligne pointillée dans les figures A et B indique le seuil de séropositivité ; Points temporels (T) lors du prélèvement de l'échantillon sanguin : T0 - Valeur de référence, T1 - Échantillon prélevé après avoir reçu la série complète de deux doses de vaccin, T2 - Échantillon prélevé avant le troisième vaccin (rappel) et T3 - Échantillon prélevé après le troisième vaccin (rappel) ; S1P (fingolimod et siponimod).
- Niveaux d'IgG anti-spike totale (A) et anti-RBD (receptor binding domain) (B) pour les différents groupes à chaque point temporel.
- Séropositivité à T3 (au moins 14 jours après la troisième dose de vaccin à ARN messager) :
- Pour les IgG anti-spike totales, qui comprennent l'activité contre tout épitope de la protéine S qui peut ne pas être corrélée aux anticorps neutralisants, 62,5 % (5/8) de l'atumumab, 75,5 % (9/12) de l'ocrélizumab, 100 % (7/7) de la S1P et 100 % (7/7) des volontaires sains.
- Pour les IgG anti- spike et anti-RBD, qui sont plus spécifiques et constituent un meilleur corrélat des anticorps neutralisants, 62,5 % (5/8) de l'atumumab, 50,0 % (6/12) de l'ocrélizumab, 71,4 % (5/7) du S1P et 100 % (7/7) des volontaires sains.
Figure Réponse des cellules T - La proportion de cellules T CD4+ (A) et de cellules T CD8+ (B) qui réagissent à la protéine S est indiquée pour les différents groupes de traitement à chaque point temporel
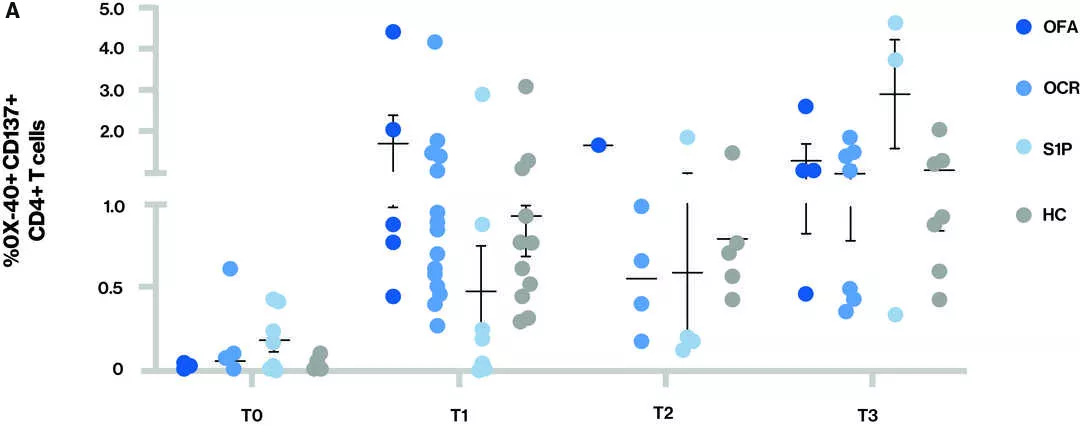
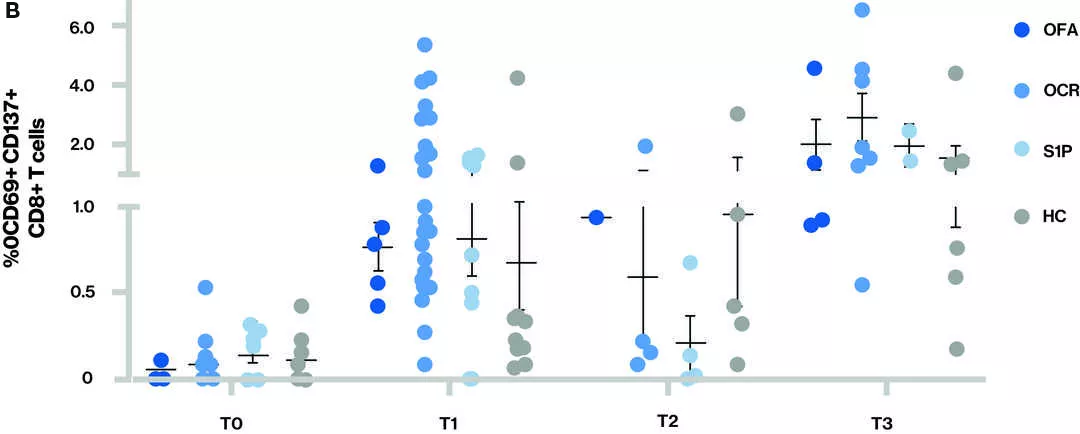
Points temporels (T) lors du prélèvement des échantillons sanguins : T0 – Valeur de référence, T1 - Échantillon prélevé après avoir reçu la série complète de deux doses de vaccin, T2 - Échantillon prélevé avant le troisième vaccin (rappel) et T3 - Échantillon prélevé après le troisième vaccin (rappel) ; S1P (fingolimod et siponimod)
- À T3, tous les participants semblaient avoir une réponse des cellules T CD4 et CD8.
Dans cette analyse intermédiaire de patients adultes atteints de SEP sous S1P (fingolimod et siponimod) et anti-CD20 (ocrélizumab et ofatumumab), alors que la réponse immunitaire était globalement atténuée, une majorité de patients dans tous les groupes TMM (> 70 % S1P et > 50 % anti-CD20) ont présenté une réponse anticorps à la 3e vaccination (rappel). Tous les patients adultes atteints de SEP sous S1P et anti-CD20 ont présenté une réponse des cellules T au 3ème vaccin (rappel) dans tous les groupes TMM.