COVID-19
Ultimo aggiornamento: giugno 2022. La pagina verrà aggiornata ogni due anni
It looks like you are using an older version of Internet Explorer which is not supported. We advise that you update your browser to the latest version of Microsoft Edge, or consider using other browsers such as Chrome, Firefox or Safari.
Ultimo aggiornamento: giugno 2022. La pagina verrà aggiornata ogni due anni
Novartis monitora regolarmente i casi di COVID-19 nei pazienti in terapia con siponimod. In base alla totalità dei dati disponibili dai case report sul COVID-19 nel contesto delle sperimentazioni cliniche e post-marketing e all’analisi completa dei dati da parte di MS Data Alliance GDSI1
|
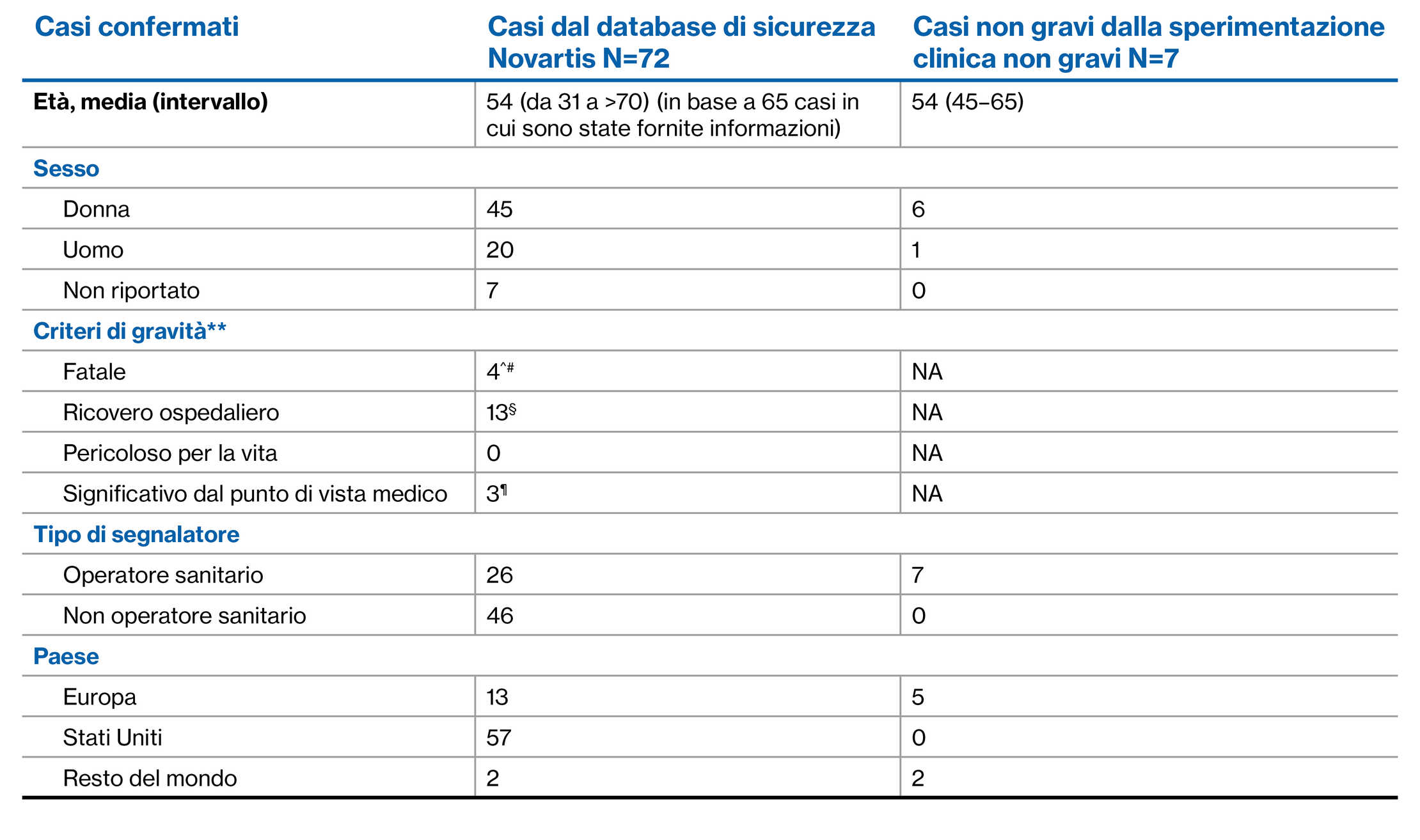
Alla data del 25 marzo 2022, con un’esposizione cumulativa di oltre 15.163 anni-paziente, un totale di 267casi, sia casi COVID confermati** (n=262) che sospetti^ (n=5), è stato identificato con il trattamento con siponimod nel contesto post-marketing.2 Alla data del 29 ottobre 2021, vi sono stati 54 casi da sperimentazioni cliniche in corso, con 53 casi confermati** e uno sospetto^.3 |

Sperimentazioni cliniche ed estensioni in aperto

Dei 262 casi confermati di COVID-19, 75 erano casi gravi
Dei 53 casi confermati di COVID-19, 17 erano casi gravi

Infezione da COVID-19: casi confermati 2,3
Novartis monitora regolarmente la risposta clinica al vaccino anti-COVID-19 nei pazienti in terapia con siponimod ricevuto nell’ambito di sperimentazioni cliniche o contesti post-marketing.
Nelle sperimentazioni cliniche, dei 320 pazienti completamente vaccinati (altri 45 pazienti hanno ricevuto una dose parziale, 7 pazienti hanno avuto un’infezione da COVID-19ʆ (cioè, ≥2 settimane dopo la 2a dose di vaccino, o ≥2 settimane dopo una dose di regime di dosaggio singolo). Ciò include un paziente con comorbidità che ha avuto un esito fatale e 6 pazienti che sono guariti.

ɭ Tutta la profilassi pre e post-esposizione deve essere somministrata secondo le linee guida locali e le corrispondenti informazioni sul prodotto.

This website is for non-promotional purposes and is intended for providing
safety information for healthcare professionals (HCPs) Only
Please confirm that you are an HCP
For HCPs: Information on this website is not country specific, and may contain information that is outside the approved indications in the country in which you are located. Please contact your local Novartis representative for the latest information specific to your country.
For non-HCPs / patients: This safety website is available for HCPs only
Il programma di monitoraggio intensivo dell’esito della gravidanza (PRIM) si basa sulla migliore farmacovigilanza del sistema di segnalazione spontanea di Novartis. Il PRIM è un programma di monitoraggio intensivo degli esiti degli eventi avversi volto a raccogliere informazioni (liste di controllo di follow-up mirate) sulla gravidanza in pazienti esposte a siponimod immediatamente prima o durante la gravidanza e gli esiti nei neonati 12 mesi dopo il parto.