COVID-19
最終更新日:2021年8月。ページは1年に2回更新されます
It looks like you are using an older version of Internet Explorer which is not supported. We advise that you update your browser to the latest version of Microsoft Edge, or consider using other browsers such as Chrome, Firefox or Safari.
最終更新日:2021年8月。ページは1年に2回更新されます
Novartisは、シポニモドで治療されている患者において、COVID-19の症例を定期的にモニタリングしています。リスク評価は、臨床試験と市販後に報告されたCOVID-19症例のデータ解析、ならびにMS Data Alliance GDSIによる包括的なデータ解析に基づいて実施されています1
|
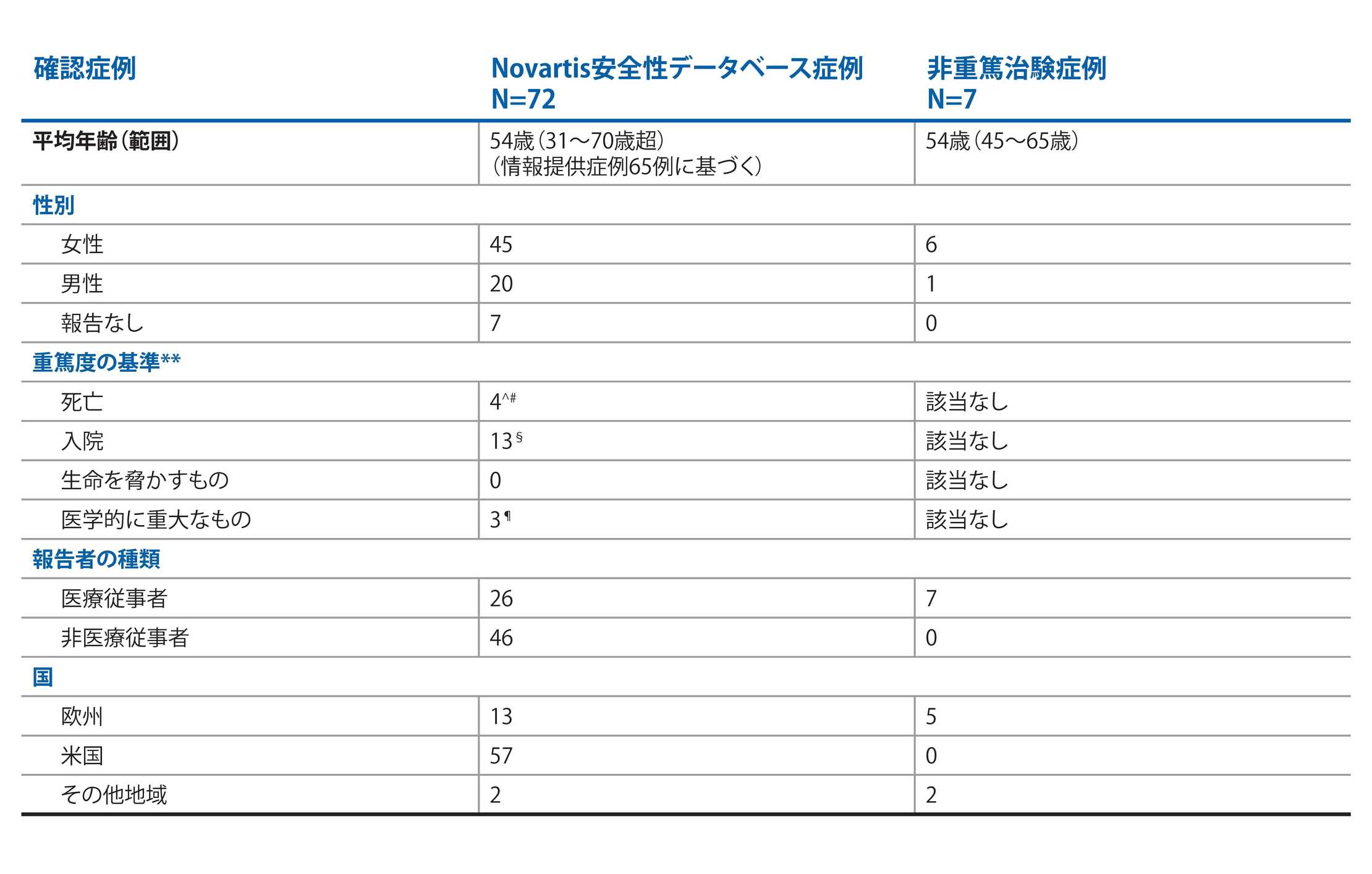
2021年3月25日現在、>12,000患者年の累積曝露の中で計83例のCOVID-19症例が報告されている。83例中、79例が確定症例(SARS-CoV2検査陽性、またはCOVID-19確定診断の記録がある症例)、4例が疑い症例でした。確定症例79例のうち、72例がNovartisの安全性データベースからの症例で、2残りの7例が継続中の臨床試験から報告された症例(非重篤)でした3 |

COVID-19が確認された72例のうち、4例が臨床試験で報告された重篤例であり、68例が市販後症例(重篤例16例、非重篤例52例)でした
臨床試験において報告された非重篤例 7例の詳細

COVID-19感染症:確定症例2、3

現在までに入手可能な承認済みSARS-CoV-2ワクチンは、4つのカテゴリーに分類されます:(1) mRNAワクチン、(2) 非複製ウイルスベクターワクチン、(3) 不活化ワクチン、(4) 組換えタンパクワクチン

This website is for non-promotional purposes and is intended for providing
safety information for healthcare professionals (HCPs) Only
Please confirm that you are an HCP
For HCPs: Information on this website is not country specific, and may contain information that is outside the approved indications in the country in which you are located. Please contact your local Novartis representative for the latest information specific to your country.
For non-HCPs / patients: This safety website is available for HCPs only
Pregnancy outcome Intensive Monitoring(PRIM)プログラムは、Novartisの自発報告システムに基づく追加の医薬品安全性監視プログラムです。PRIMでは、妊娠直前または妊娠中にシポニモドに曝露された患者の妊娠および出産後12ヵ月後の乳児の転帰に関する情報が収集されます