EXPAND
Disegno dello studio
Disegno dello studio di fase 3 EXPAND: Il disegno basato sugli eventi ha consentito un periodo di osservazione adeguato per la valutazione dell’efficacia e della sicurezza, riducendo l’esposizione al placebo1
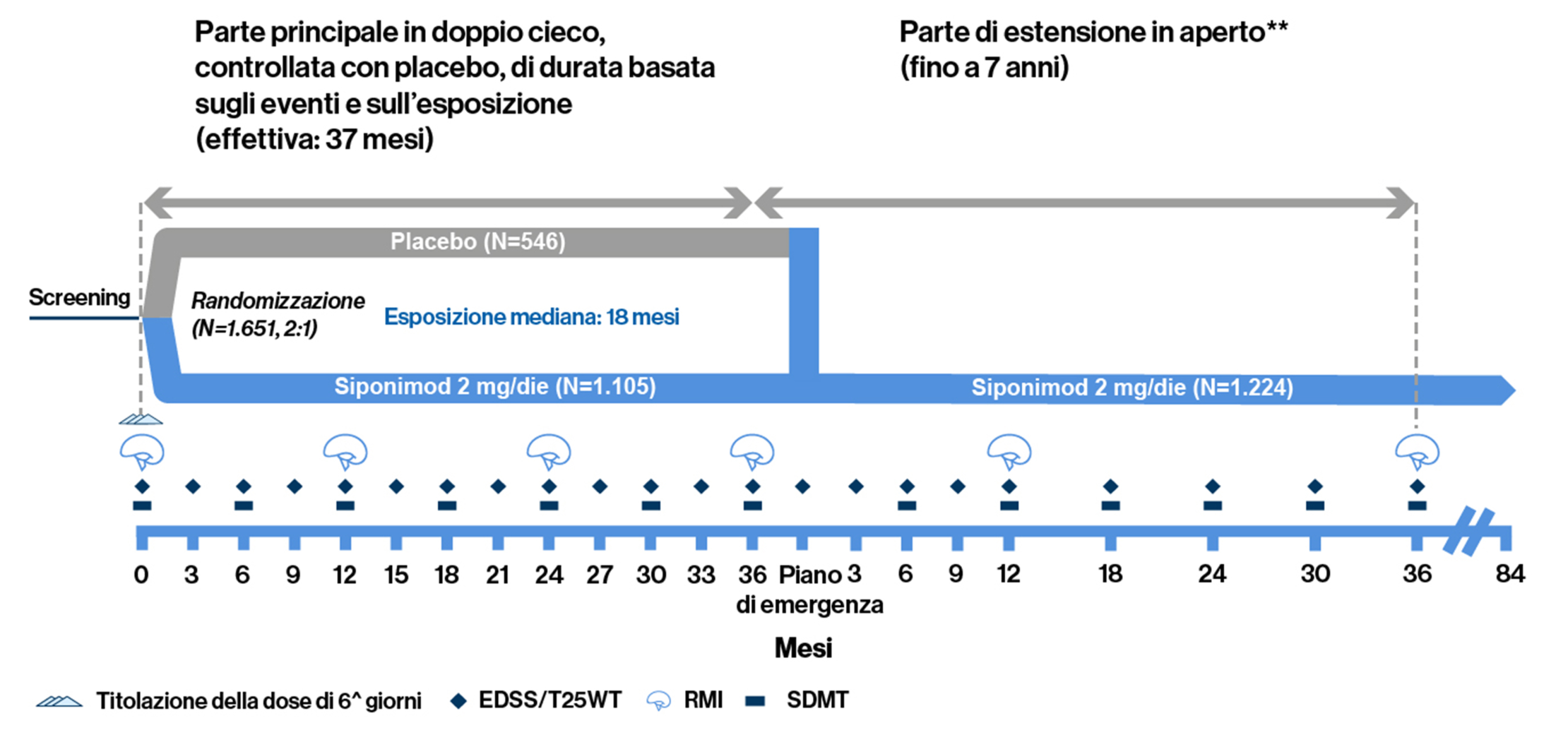
*La parte in aperto inizia quando un paziente ha un “evento”. **Il trattamento è stato avviato con un periodo di titolazione di 6 giorni (0,25 mg-2 mg) con la prima dose di mantenimento di 2 mg raggiunta il Giorno 6.
Lo studio di fase 3 EXPAND era una parte principale randomizzata, a gruppi paralleli, in doppio cieco, controllata con placebo, basata sugli eventi e basata sull’esposizione (fino a 3 anni) seguita da una parte di estensione in aperto (fino a 7 anni), che ha raccolto dati a lungo termine per valutare l’efficacia e la sicurezza di siponimod, per un massimo di 10 anni. I pazienti (età 18–60 anni) con SMSP e punteggio EDSS di 3,0–6,5 sono stati assegnati casualmente (2:1) a ricevere siponimod 2 mg o placebo una volta al giorno per via orale per un massimo di 3 anni o fino al verificarsi di un numero prespecificato di eventi di progressione confermata della disabilità (CDP). L’endpoint primario era il tempo alla CDP a 3 mesi. La CDP è stata definita come un aumento di 1 punto nella scala EDSS se il punteggio al basale era 3,0-5,0 o un aumento di 0,5 punti se il punteggio al basale era 5,5-6,5, confermato a una visita programmata almeno 3 mesi dopo. I due endpoint secondari principali erano il tempo alla CDP a 3 mesi di almeno il 20% rispetto al basale nel test di deambulazione T25FW e la variazione rispetto al basale del volume lesionale in T21
- Erano necessari 374 eventi di 3mCDP e ≥1 anno di esposizione per >95% dei pazienti randomizzati
- I pazienti con 6mCDP hanno avuto la possibilità di passare a siponimod in aperto o ad altre DMT rimanendo nella parte principale dello studio
- In occasione dell’EoCP, i pazienti hanno avuto la possibilità di accedere alla fase di estensione in aperto ancora in corso e di ricevere siponimod per un massimo di altri 7 anni

Popolazione di EXPAND: Dati demografici dei pazienti e caratteristiche della malattia al basale1
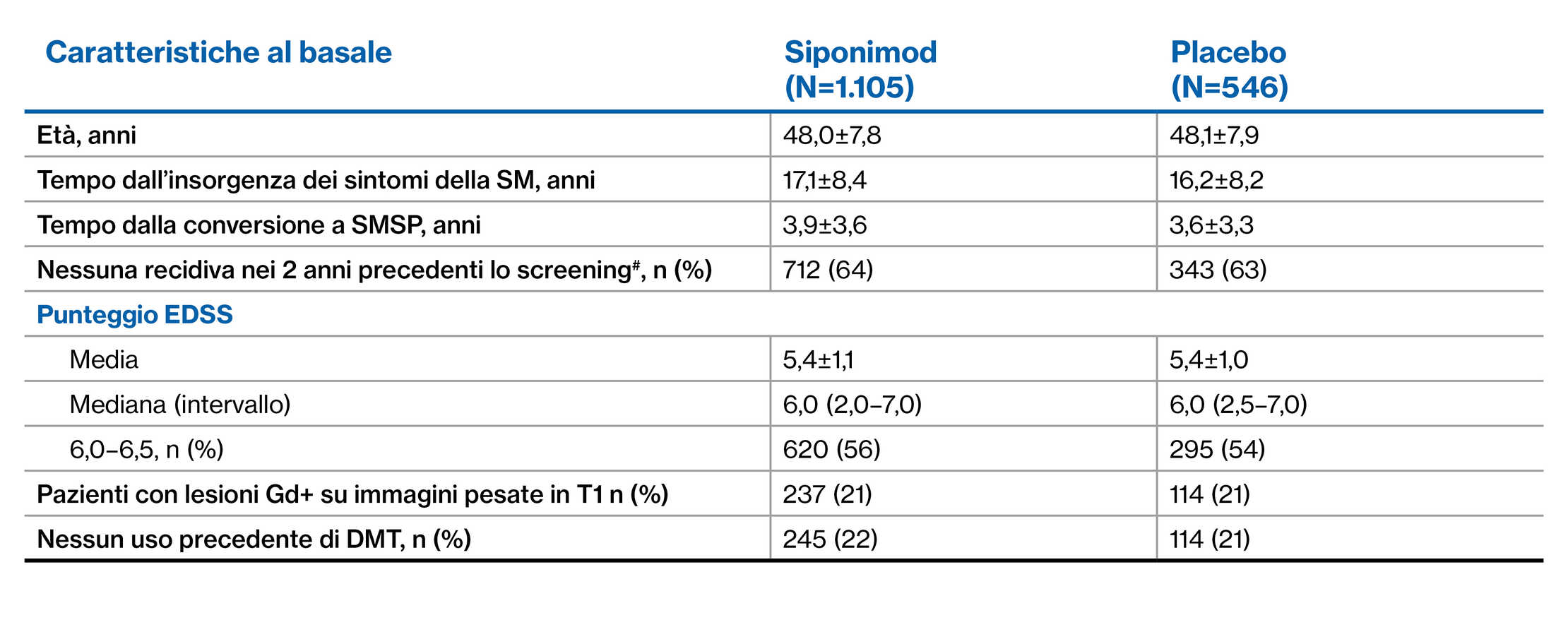
#I dati sono presentati come media±DS, se non diversamente specificato
^Le informazioni sul numero di recidive negli ultimi 2 anni non erano disponibili per tre pazienti nel gruppo siponimod e per un paziente nel gruppo placebo

Popolazione con SMSP di EXPAND e in sperimentazioni di fase 3 sulla SMR: Dati demografici dei pazienti e caratteristiche della malattia al basale1‒7
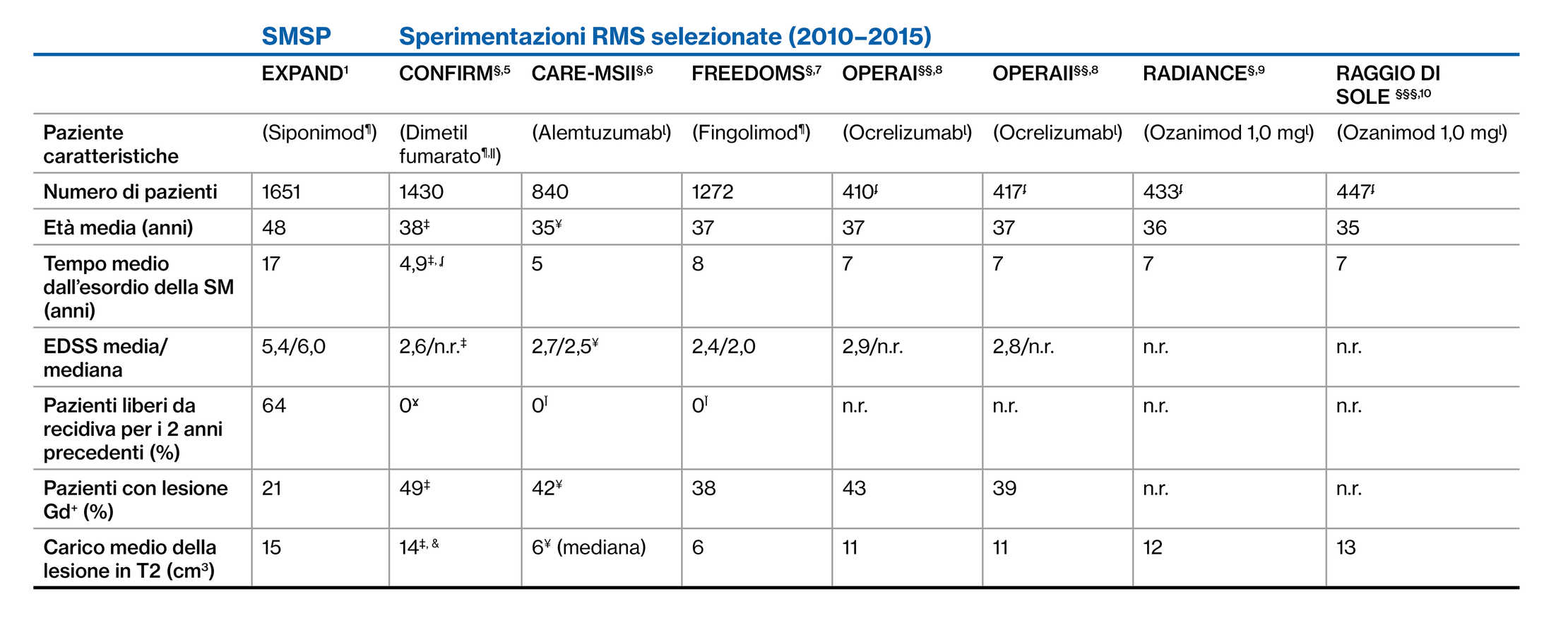
Poiché non vi sono studi di confronto diretto tra siponimod e questi farmaci, non è stato possibile effettuare comparazioni a causa delle differenze nel disegno dello studio
§A 2 anni; §§At 96 settimane; §§§At 12 mesi; ¶Comparatore placebo; ǁComparatore glatiramer acetato; ɭIComparatore IFN β-1a; ¥Include i dati dei pazienti che hanno ricevuto ocrelizumab o ozanimod; ‡solo nel braccio con dimetifumarato due volte al giorno; ʆsolo nel braccio con alemtuzumab 12 mg; Ĭtempo dalla diagnosi; ¥sulla base dei criteri di inclusione; Ɣpunteggio EDSS superiore a 5,0; Ĭcoorte con MRI
