EXCHANGE
Risultati dell’analisi ad interim1
Bar-Or A, et al. Safety and tolerability of conversion to siponimod in patients with relapsing multiple sclerosis: interim results of the EXCHANGE study. Presentazione di poster all’ACTRIMS-ECTRIMS. 2020;P0233.
- EXCHANGE ha valutato il profilo complessivo di sicurezza e tollerabilità in pazienti con SMR in progressione o un’anamnesi di SMR che hanno effettuato la conversione da DMT iniettabili e orali a siponimod con titolazione della dose senza washout
-
Sperimentazione prospettica, multicentrica, in aperto, a braccio singolo
-
113 pazienti inclusi nell’analisi ad interim di 42 centri negli Stati Uniti; 1 paziente nel braccio virtuale
-
Pazienti con ≥1 EA (34,8%)
-
I SAE e gli EA che hanno portato all’interruzione del farmaco erano bassi
‒ Cinque pazienti hanno manifestato ≥1 SAE*, sei pazienti hanno manifestato ≥1 EA^
-
Nessuna riduzione significativa rispetto al basale della frequenza cardiaca media a 6 ore dopo la dose del Giorno 1
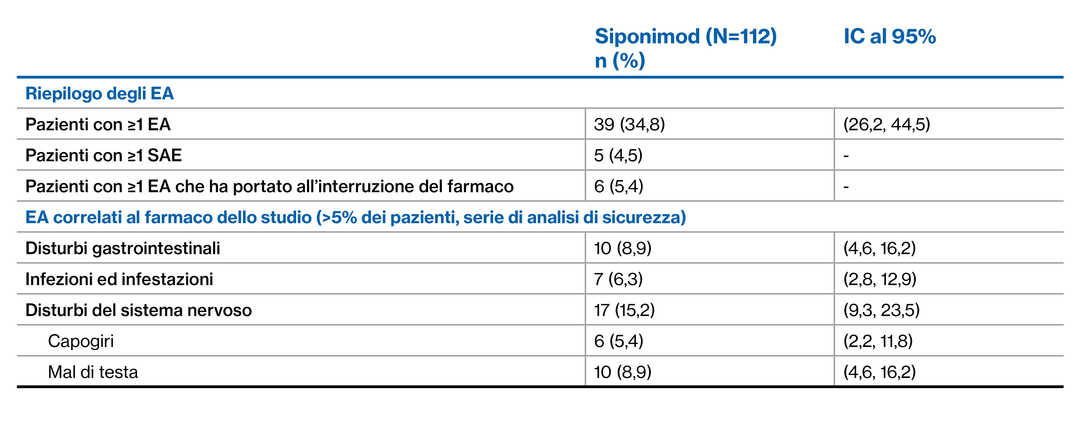
La conversione da DMT orali/iniettabili a siponimod senza washout ha avuto un profilo di sicurezza e tollerabilità accettabile, senza risultati inattesi
(New) COVID-19 vaccination EXCHANGE sub-study
**Molteplici SAE possono verificarsi in 1 paziente; ^molteplici EA che portano all’interruzione del farmaco possono verificarsi in 1 paziente
