EXPAND
Studiendesign
EXPAND- (Phase III) Studie: Das ereignisorientierte Design ermöglichte einen angemessenen Beobachtungszeitraum für die Bewertung der Wirksamkeit und Sicherheit bei gleichzeitiger Reduzierung der Exposition gegenüber Placebo1
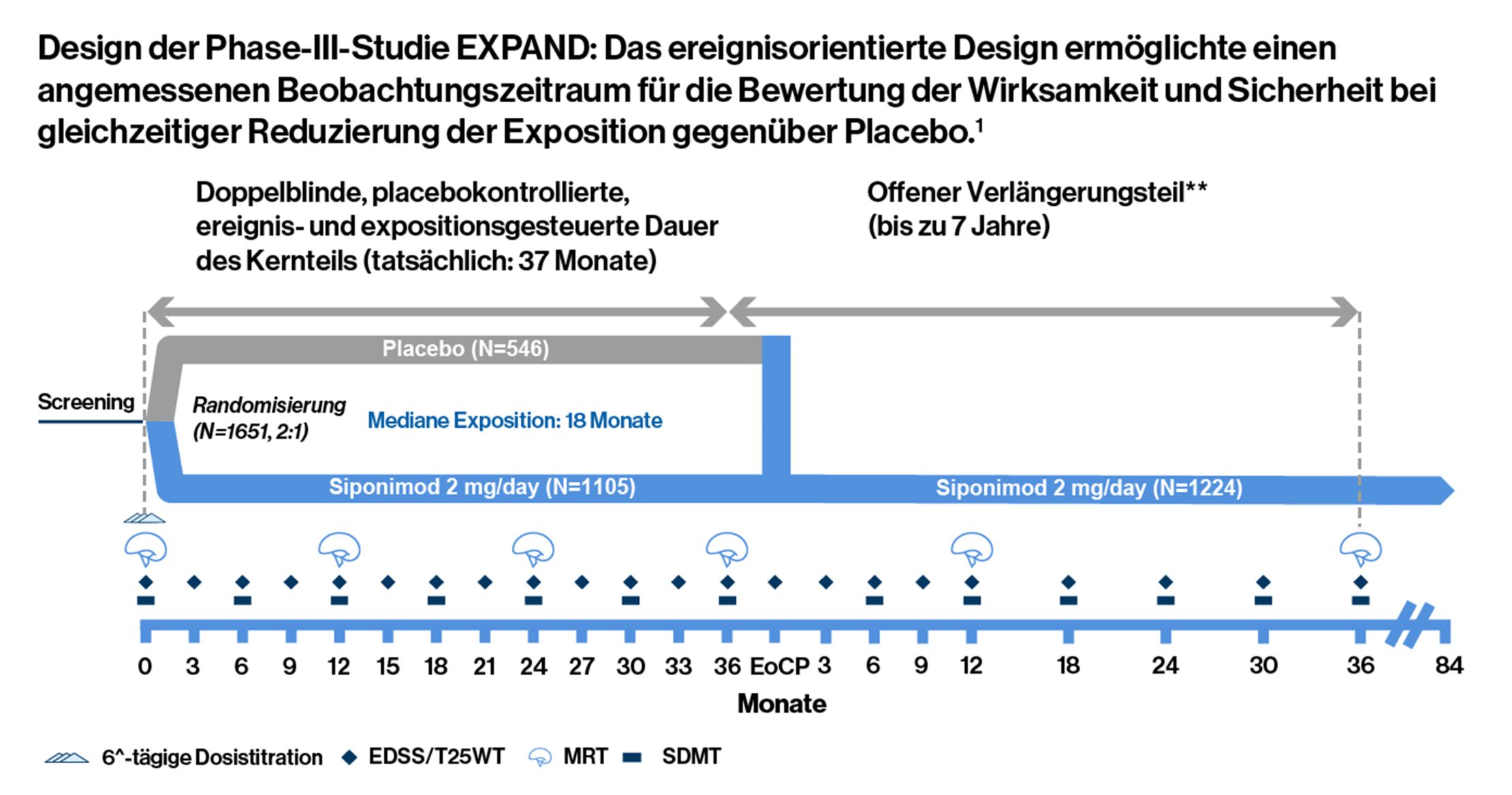
**Der offene Teil beginnt, wenn bei einem Patienten ein „Ereignis“ eintritt. **Die Behandlung wurde mit einer 6-tägigen Titrationsphase (0,25 mg-2 mg) eingeleitet, wobei die erste Erhaltungsdosis von 2 mg an Tag 6 erreicht wurde..
Bei der EXPAND- (Phase III) Studie handelte es sich um einen randomisierten, doppelblinden, placebokontrollierten, ereignis- und expositionsgesteuerten Hauptteil, mit parallelen Gruppen (bis zu 3 Jahre), gefolgt von einem offenen Extensionsteil (bis zu 7 Jahre), in dem Langzeitdaten zur Bewertung der Wirksamkeit und Sicherheit von Siponimod über einen Zeitraum von bis zu 10 Jahren erhoben wurden. Patienten (im Alter von 18 bis 60 Jahren) mit SPMS und einem EDSS-Score von 3,0 bis 6,5 wurden nach dem Zufallsprinzip (2:1) einer einmal täglichen oralen Gabe von Siponimod 2 mg oder Placebo für bis zu drei Jahre oder bis zum Auftreten einer vorgegebenen Anzahl von CDP-Ereignissen zugewiesen. Der primäre Endpunkt war die Zeit bis zur 3-monatigen CDP. CDP wurde definiert als ein Anstieg des EDSS um 1 Punkt, wenn der Ausgangswert 3,0-5,0 betrug, oder ein Anstieg um 0,5 Punkte, wenn der Ausgangswert 5,5-6,5 betrug, der bei einem geplanten Besuch mindestens 3 Monate später bestätigt wurde. Die beiden wichtigsten sekundären Endpunkte waren die Zeit bis zum Erreichen einer CDP von mindestens 20 % gegenüber dem Ausgangswert nach 3 Monaten im T25FW-Test und die Veränderung des T2-Läsionsvolumens gegenüber dem Ausgangswert1
- 374 Ereignisse von 3mCDP und ≥ 1 Jahr Exposition für > 95 % der randomisierten Patienten waren erforderlich
- Patienten mit 6mCDP hatten die Möglichkeit, auf Siponimod oder andere DMT umzusteigen, während sie im Kernteil der Studie blieben
- Beim EoCP hatten die Patienten die Möglichkeit, an dem noch laufenden offenen Extensionsteil der Studie teilzunehmen und Siponimod für bis zu weitere 7 Jahre zu erhalten

EXPAND- Population: Demografische Daten der Patienten und Merkmale der Grunderkrankung1
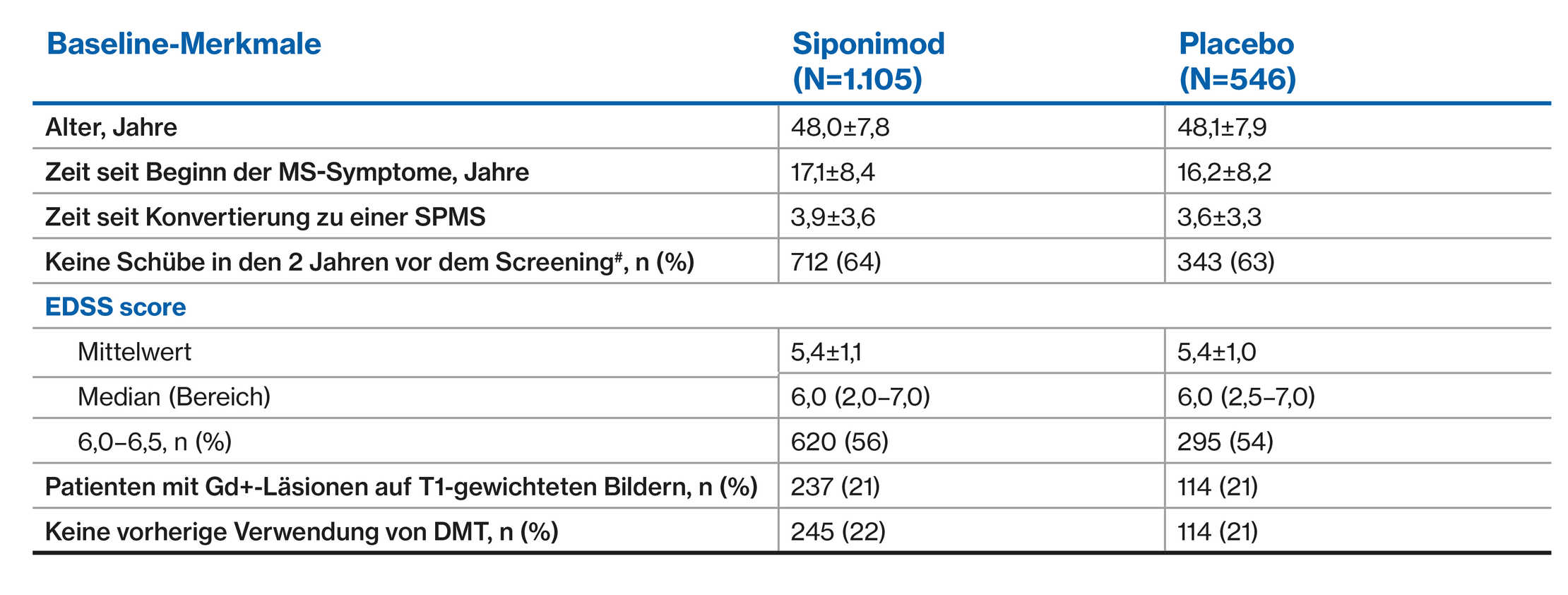
#Die Daten werden als Mittelwert ± SD dargestellt, sofern nicht anders angegeben
^Für drei Patienten in der Siponimod-Gruppe und einen Patienten in der Placebo-Gruppe lagen keine Informationen über die Anzahl der Rückfälle in den letzten 2 Jahren vor

EXPAND SPMS-Population und Phase III-RMS-Studien: Demografische Daten der Patienten und Merkmale der Grunderkrankung1‒7
Da es keine direkten Vergleichsstudien zu Siponimod mit diesen Wirkstoffen gibt, konnten aufgrund von Unterschieden im Studiendesign keine Vergleiche angestellt werden
§Nach 2 Jahren; §§Nach 96 Wochen; §§§Nach 12 Monaten; ¶Placebo-Vergleichspräparat; ǁGlatirameracetat-Vergleichspräparat; ǁIFN β-1a-Vergleichspräparat; ɭbeinhaltet nur Daten von Patienten, die Ocrelizumab oder Ozanimod erhielten; ‡nur Alemtuzumab 12 mg-Arm; ʆZeit seit der Diagnose; ĬEDSS-Score höher als 5,0; Ɣbasierend auf Einschlusskriterien; &ĬMRI-Kohorte ; ʄbeinhaltet nur Daten von Patienten, die Ocrelizumab oder Ozanimod erhielten
